2020年8-9月CRISPR/Cas研究进展
来源:本站原创 2020-09-30 22:09
2020年9月30日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。 图片来自Thoma
2020年9月30日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。

2018年11月26日,中国科学家贺建奎声称世界上首批经过基因编辑的婴儿---一对双胞胎女性婴儿---在11月出生。他利用一种强大的基因编辑工具CRISPR-Cas9对这对双胞胎的一个基因进行修改,使得她们出生后就能够天然地抵抗HIV感染。这也是世界首例免疫艾滋病基因编辑婴儿。这条消息瞬间在国内外网站上迅速发酵,引发千层浪。有部分科学家支持贺建奎的研究,但是更多的是质疑,甚至是谴责。
即将过去的8至9月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这两个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Nat Commun:利用AIOD-CRISPR超灵敏地可视化检测新冠病毒
doi:10.1038/s41467-020-18575-6
在一项新的研究中,在康涅狄格大学健康中心生物医学工程系副教授Changchun Liu博士的领导下,研究人员开发出的这种称为“All-In-One-Dual CRISPR-Cas12a(AIOD-CRISPR)”的方法简单地、快速地、超灵敏地可视化检测SARS-CoV-2,可在家庭或小诊所使用。相关研究结果于2020年9月18日发表在Nature Communications期刊上,论文标题为“Ultrasensitive and visual detection of SARS-CoV-2 using all-in-one dual CRISPR-Cas12a assay”。
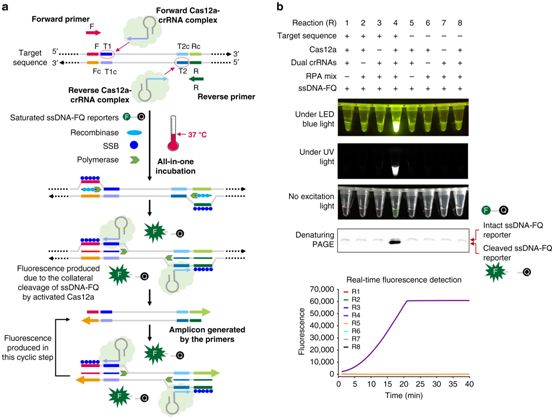
在这项新的研究中,Liu和他的研究团队使用28个临床COVID-19拭子样本的RNA提取物评估了他们的AIOD-CRISPR方法,其中包括8个COVID-19阳性样本。为了确保检测的可靠性,每个样本都在两个独立的实验中测试了两次。所有8个COVID-19阳性样本均在40分钟内确诊为阳性,而且是通过目视检测予以确认的。这些结果也与美国疾控中心(CDC)批准的RT-PCR方法的结果一致。
这些研究人员还使用低成本的暖手宝作为孵育器来检测患者样本,以消除对电孵育器的需求。AIOD-CRISPR试管被直接放置在一个气动的暖手宝上,在LED灯下用肉眼就可以看到检测结果。
2.Mol Cell:新研究揭示DNA损伤后的组蛋白降解促进DNA修复
doi:10.1016/j.molcel.2020.09.002
DNA损伤可能发生在基因组的任何地方,但大多数DNA被包裹在核小体上,这就使得修复复合体无法进入。如今,在一项新的研究中,来自瑞士弗雷德里希米歇尔生物医学研究所和巴塞尔大学等研究机构的研究人员发现DNA会诱导组蛋白耗竭,这增加了DNA纤维的可访问性和灵活性,并提高了同源重组修复过程中的同源搜索速度。相关研究结果于2020年9月23日在线发表在Molecular Cell期刊上,论文标题为“DNA Damage-Induced Nucleosome Depletion Enhances Homology Search Independently of Local Break Movement”。论文通讯作者为Susan M.Gasser博士。
在这项新的研究中,Cheblal及其同事们强调,组蛋白降解和随后的染色质解压缩(chromatin decompaction)确实会提高DNA修复效率和动力学。Cheblal总结了这项研究的主要发现:“我们发现,DNA双链断裂可以通过组蛋白的受控降解引发异位的染色质解压缩[指的是在远处未受损的位点,而非局部],这对基于同源重组的DNA修复至关重要。我们还发现,局部断裂动态对DNA修复不那么重要,可以通过增加异位染色质移动来加以弥补,而异位染色质移动与染色质解压缩相关。此外,我们排除了之前的一个假设:染色体从核外周脱离是DNA损伤反应的一部分。”
当被问及这项研究的更广泛影响时,Cheblal说,“我们的研究将对CRISPR介导的基因疗法至关重要,目前这种疗法的效率太低,无法用于临床。我们的研究结果表明将这项技术与经过适当上调的因子结合起来诱导组蛋白降解,可能会提高CRISPR-Cas9的编辑效率。”
通过同源重组修复DNA是CRISPR-Cas9靶向基因组编辑的基本原理。CRISPR-Cas9编辑技术主要作为研究工具,但也用于基因治疗。初步研究表明,在哺乳动物细胞中,随着组蛋白的耗竭,CRISPR-Cas9的编辑效率可以提高。
3.Nature子刊:经改进靶向毒性RNA的CRISPR-Cas9有望治疗强直性肌营养不良I型
doi:10.1038/s41551-020-00607-7
CRISPR-Cas9是一种越来越多地用于校正导致各种疾病的基因(DNA)缺陷的技术。几年前,美国加州大学圣地亚哥医学院的研究人员改变了这种技术的作用方向:用一种他们称之为RNA靶向Cas9(RNA-targeting Cas9, RCas9)的方法来修饰RNA。
在一项新的研究中,这些研究人员证实一剂RCas9基因疗法可降解有毒的RNA,并且几乎完全逆转强直性肌营养不良小鼠模型的症状。相关研究结果于2020年9月14日在线发表在Nature Biomedical Engineering期刊上,论文标题为“The sustained expression of Cas9 targeting toxic RNAs reverses disease phenotypes in mouse models of myotonic dystrophy type 1”。
这些研究人员将RCas9包装在一种非感染性病毒中,这种病毒载体将这种RNA切割酶递送到细胞内。他们给这些小鼠注射了单剂RCas9基因疗法或模拟治疗(mock treatment,指的是未包装RCas9的病毒载体)。RCas9将异常的重复性RNA减少了50%以上,根据组织的不同而有所变化,而且治疗后的强直性肌营养不良小鼠变得与健康小鼠基本没有区别。
4.NEJM:COVID-19快速检测有望提升准确度
doi:10.1056/NEJMc2026172
自从COVID-19大流行开始以来,麻省理工学院以及哈佛大学的研究人员,以及致力于开发基于CRISPR的COVID-19诊断程序,该程序可以在30分钟到一个小时内产生结果,其准确性与现在使用的标准PCR诊断程序相似。
该名为STOPCovid的新测试仍处于研究阶段,但原则上可以廉价地制造,人们可以每天进行自我检测。在《New England Journal of Medicine》杂志上发表的一项研究中,研究人员表明,在一组患者样本中,他们的检测发现了93%的阳性病例。
具体而言,研究人员通过添加吸引RNA的磁珠来浓缩患者样品中的病毒遗传物质,从而无需使用费时且昂贵的纯化试剂盒。由于需求量大。此浓缩步骤提高了测试的灵敏度,直到接近PCR的灵敏度。
5.Nat Biotechnol:科学家有望利用酶类测试来改善CRISPR基因编辑工具的精准性和有效性!
doi:10.1038/s41587-020-0646-5
近日,一项刊登在国际杂志Nature Biotechnology上的研究报告中,来自德克萨斯大学等机构的科学家们通过研究开发了一种新工具能帮助科学家们为特定的工作选择最佳的可用基因编辑选项,从而就使得CRISPR技术更加安全、便宜和高效。近年来,CRISPR基因编辑技术在改善人类健康、农业研究等方便表现出了巨大的潜力,但其所面临的挑战在于基因编辑的微妙性质,即不允许出错,为了实现基因编辑,科学家们会使用来自名为CRISPR的自然系统中几十种不同的酶类,随后他们会锁定出问题的DNA序列,紧接着利用酶类作为剪刀来剪断错误序列,使得遗传物质被添加、移除或改变,但这些剪刀或许并不完美,其准确性和有效性会因CRISPR酶和项目而异,而且新的工具会引导新的用户,因此研究者可以为其高风险的基因编辑选择最好的CRISPR酶类。
研究者Steve Jones博士表示,我们设计了一种新方法,其能帮助检测这些不同的CRISPR酶的特异性,其能以一种前所未有的方式来对抗任何引起DNA序列的改变;当CRISPR酶靶向作用了错误的DNA片段后问题就会出现,每一种CRISPR酶在编辑不同的序列上都会存在一定的优缺点,因此研究人员就开始着手开发一种工具来帮助科学家们比较不同的酶类并寻找你一种能发挥用途的最佳酶类。
6.Nat Cell Biol:利用CRISPR对免疫反应进行编辑,使得基因疗法更有效
doi:10.1038/s41556-020-0563-3
基因治疗一般依靠腺相关病毒(AAV)等病毒将基因递送到细胞中。在基于CRISPR的基因疗法中,分子剪刀可以移除有缺陷的基因,并添加一个缺失的序列或暂时改变它的表达,但人体对AAV的免疫反应会阻碍整个努力。
为了克服这一障碍,来自美国匹兹堡大学医学院的研究人员在一项新的研究中构建出一种以不同方式使用CRISPR的系统。他们的系统短暂地抑制了与AAV抗体产生有关的基因,这样这种病毒就可以不受阻碍地递送它携带的基因货物。相关研究结果近期发表在Nature Cell Biology期刊上,论文标题为“Synthetic immunomodulation with a CRISPR super-repressor in vivo”。
7.Sci Adv:新型基因疗法有望治疗遗传性失明患者
doi:10.1126/sciadv.aba5614
色素性视网膜炎是一种最常见的先天性失明症,近日,一项刊登在国际杂志Science Advances上的研究报告中,来自德国慕尼黑大学等机构的科学家们通过对色素性视网膜炎小鼠模型进行研究发现,靶向激活具有相似功能的基因或能弥补主要的缺陷。
研究者Becirovic表示,目前有两种策略用于基因疗法的开发,在基因补充的背景下,研究者会试图利用完整的基因版本来替代缺陷的基因,然而这种策略仅适用于相对较少的基因;而第二种策略的目标就是纠正诱发疾病的突变,但这通常需要针对每个单独的突变量身定做,为了克服这些困难,研究人员通过研究开发出了一种新型策略;人类基因组中的许多基因都属于某些家族,其家族成员在不同类型的细胞中发挥着相类似的功能,或者在特定细胞类型分化的过程中的不同阶段会被激活,研究人员的想法就是通过特异性地激活具有相似功能但在视网膜细胞中并不表达的基因来弥补突变基因缺失的功能,为了做到这一点,研究人员将名为Cas9-VPR的系统运输到了受影响的视网膜细胞中开始进行研究。
Cas9-VPR系统是CRISPR/Cas9技术的衍生技术,与经典的CRISPR/Cas9技术相似的是,Cas9-VPR能利用相同的靶向原则来引导激活的蛋白质进入感兴趣的特定基因位点发挥作用;随后研究者利用色素性视网膜炎小鼠模型来检测这种技术,这些小鼠模型缺乏在正常情况下能在视网膜视杆细胞中进行表达的光敏视紫红蛋白,在一种无害病毒的帮助下,研究人员将Cas9-VPR系统成功导入到了视杆细胞中,当将Cas9-VPR系统引入到小鼠的视杆细胞后,研究人员就能够开启与视紫红质基因密切相关的基因的表达,视紫质基因在负责颜色和白天视觉的视锥细胞中通常情况下处于激活状态;以这种方式,研究人员就能弥补视杆细胞中视紫红质功能的缺失,从而就能降低视网膜退行性病变的速度,并能改善视网膜的功能,从而还不对患者机体产生明显的副作用。
8.PLoS Pathog:我国科学家开发出一种快速、准确、低成本的COVID-19测试方法
doi:10.1371/journal.ppat.1008705
在一项新的研究中,来自中国广东省医学科学院、云南农业大学、中国医学科学院、北京协和医学院、复旦大学附属华山医院和徐州医科大学附属医院等研究机构的研究人员报道一种新型低成本的COVID-19测试方法可在不需要复杂设备的情况下快速提供准确的测试结果。相关研究结果于2020年8月27日发表在PLoS Pathogens期刊上,论文标题为“Development and evaluation of a rapid CRISPR-based diagnostic for COVID-19”。
在这项新的研究中,这些研究人员利用近年来广泛用于基因编辑的CRISPR技术,开发了一种替代性的COVID-19测试方法。这种被命名为CRISPR-COVID的测试方法能够高通量检测SARS-CoV-2--导致COVID-19的新型冠状病毒。CRISPR-COVID可在短短40分钟内提供与mNGS相当的灵敏度和特异性。当大规模生产时,CRISPR-COVID测试的材料成本可低于70美分,这表明CRISPR-COVID不仅在技术上,而且在财务上也是一个有竞争力的替代方案。
9.Science子刊:重大进展!移植经过CRISPR基因编辑的人棕色脂肪样细胞有望治疗肥胖和糖尿病
doi:10.1126/scitranslmed.aaz8664
肥胖是导致2型糖尿病和相关慢性疾病的主要原因,今年它在全球引起的死亡人数加起来将超过新型冠状病毒SARS-CoV-2。在一项新的研究中,来自美国哈佛医学院、中国医药大学、丹麦哥本哈根大学、新加坡国立大学、巴西圣保罗大学、韩国基础科学研究院和浦项科技大学等研究机构的研究人员针对这种危险的疾病,提出了一种新型细胞疗法的概念验证方法。相关研究结果发表在2020年8月26日的Science Translational Medicine期刊上,论文标题为“CRISPR-engineered human brown-like adipocytes prevent diet-induced obesity and ameliorate metabolic syndrome in mice”。
论文通讯作者、哈佛医学院乔斯林糖尿病中心的Yu-Hua Tseng博士表示,这种潜在的肥胖疗法是移植人棕色脂肪样细胞(human brown-like fat cell, HUMBLE细胞),即人类白色脂肪细胞经过基因改造后变得类似于产生热量的棕色脂肪细胞。
10.Mol Cell:中科院高彩霞课题组开发出具有高特异性和高精度的胞嘧啶碱基编辑器
doi:10.1016/j.molcel.2020.07.005
在一项新的研究中,中国科学院遗传与发育生物学研究所高彩霞(Gao Caixia)教授课题组基于截短的人APOBEC3胞嘧啶脱氨酶(A3Bctd)构建出两种新的CBE,并开发出一种高通量检测方法,用于评估植物CBE中不依赖于单向导RNA(sgRNA)的脱氨变化。相关研究结果于2020年7月27日在线发表在Molecular Cell期刊上,论文标题为“Rationally Designed APOBEC3B Cytosine Base Editors with Improved Specificity”。
他们首先开发了一种快速、高通量且廉价的方法---nSaCas9介导的正交R环测定法---来评估植物中的CBE。在这种测定法中,正交CRISPR系统nSaCas9被用于在植物细胞中产生单链DNA(ssDNA)区域,作为不依赖于sgRNA的脱氨变化的靶标。为了评估nSaCas9介导的正交R环测定,他们将它与全基因组测序(WGS)测定进行了比较。
一致性的结果表明,nSaCas9介导的正交R-loop测定法为评估CBE的不依赖于sgRNA的脱靶活性提供了一种合理、快速和高通量的方法。
他们随后通过合理设计构建出16个A3Bctd脱氨酶变体,并评估了它们的在靶效率(on-target efficiency)和不依赖于sgRNA的脱靶活性。他们利用nSaCas9介导的正交R环测定法对这些A3Bctd-BE3变体进行了测试,并选择了7个与高效的在靶编辑活性和下降的脱靶活性相关的突变。之后,他们将这些突变进行组合,产生了9个新的具有双氨基酸或三氨基酸替换的A3Bctd-BE3变体。通过这种方式,他们得到了两个新的CBE变体:A3Bctd-VHM-BE3和A3Bctd-KKR-BE3,这两个变体表现出高效的在靶活性和明显下降的不依赖于sgRNA的脱靶活性。
11.Mol Cell:从结构上揭示出最大最复杂的CRISPR-Cas系统的作用机制
doi:10.1016/j.molcel.2020.07.008
在一项新的研究中,来自丹麦哥本哈根大学、中国山东大学和华中农业大学的研究人员利用先进的低温电镜(CryoEM)技术成功地可视化观察最大最复杂的CRISPR-Cas系统的三维结构。他们认为这种系统可能在生物医学和生物技术方面有潜在的应用。相关研究结果于2020年7月29日在线发表在Molecular Cell期刊上,论文标题为“Structures of the Cmr-β Complex Reveal the Regulation of the Immunity Mechanism of Type III-B CRISPR-Cas”。
论文共同通讯作者、哥本哈根大学诺和诺德基金会蛋白研究中心的Guillermo Montoya教授说道,“我们解析出迄今为止所看到的最大、最复杂的CRISPR-Cas复合物的三维结构。我们如今了解了这种系统是如何在分子水平上发挥作用的。”这些研究人员研究了一种称为Cmr-β的复合物,它属于所谓的III-B型CRISPR-Cas复合物的一个亚组。
12.Science论文深度解读!基因编辑大牛揭示碱基编辑器的作用机制
doi:10.1126/science.abb1390
在短短八年内,CRISPR-Cas9已经成为基础研究和基因治疗的首选基因组编辑器。但CRISPR-Cas9也催生了其他潜在的强大DNA操纵工具,从而可能帮助修复导致遗传性疾病的基因突变。在一项新的研究中,来自美国加州大学伯克利分校的研究人员如今获得了这些最有前途的工具之一---碱基编辑器---的首个详细的三维结构,这为调整碱基编辑器使之在患者中的使用更加灵活和可控提供了一个路线图。相关研究结果发表在2020年7月31日的Science期刊上,论文标题为“DNA capture by a CRISPR-Cas9–guided adenine base editor”。
论文共同第一作者、加州大学伯克利分校博士后研究员Gavin Knott说,“我们第一次能够观察到碱基编辑器在发挥作用。如今,我们不仅可以了解它什么时候起作用,什么时候不起作用,而且还可以设计下一代碱基编辑器,使之变得更好、更适合于临床使用。”
论文共同第一作者、前加州大学伯克利分校博士后研究员Audrone Lapinaite(如今为亚利桑那州立大学助理教授)说,“我们实际上第一次观察到碱基编辑器作为两个独立的模块运行:一个是dCas9模块,它提供特异性;另一个是催化模块,它提供编辑活性。我们获得的这个碱基编辑器与它的靶标结合在一起时的结构真地给了我们一种思考Cas9融合蛋白的方法,总体而言,这给我们提供了dCas9的哪个区域更有利于与其他蛋白融合在一起的想法。”(生物谷 Bioon.com)

图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
即将过去的8至9月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这两个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Nat Commun:利用AIOD-CRISPR超灵敏地可视化检测新冠病毒
doi:10.1038/s41467-020-18575-6
在一项新的研究中,在康涅狄格大学健康中心生物医学工程系副教授Changchun Liu博士的领导下,研究人员开发出的这种称为“All-In-One-Dual CRISPR-Cas12a(AIOD-CRISPR)”的方法简单地、快速地、超灵敏地可视化检测SARS-CoV-2,可在家庭或小诊所使用。相关研究结果于2020年9月18日发表在Nature Communications期刊上,论文标题为“Ultrasensitive and visual detection of SARS-CoV-2 using all-in-one dual CRISPR-Cas12a assay”。

AIOD-CRISPR测试方法的设计与工作原理,图片来自Nature Communications, 2020, doi:10.1038/s41467-020-18575-6。
在这项新的研究中,Liu和他的研究团队使用28个临床COVID-19拭子样本的RNA提取物评估了他们的AIOD-CRISPR方法,其中包括8个COVID-19阳性样本。为了确保检测的可靠性,每个样本都在两个独立的实验中测试了两次。所有8个COVID-19阳性样本均在40分钟内确诊为阳性,而且是通过目视检测予以确认的。这些结果也与美国疾控中心(CDC)批准的RT-PCR方法的结果一致。
这些研究人员还使用低成本的暖手宝作为孵育器来检测患者样本,以消除对电孵育器的需求。AIOD-CRISPR试管被直接放置在一个气动的暖手宝上,在LED灯下用肉眼就可以看到检测结果。
2.Mol Cell:新研究揭示DNA损伤后的组蛋白降解促进DNA修复
doi:10.1016/j.molcel.2020.09.002
DNA损伤可能发生在基因组的任何地方,但大多数DNA被包裹在核小体上,这就使得修复复合体无法进入。如今,在一项新的研究中,来自瑞士弗雷德里希米歇尔生物医学研究所和巴塞尔大学等研究机构的研究人员发现DNA会诱导组蛋白耗竭,这增加了DNA纤维的可访问性和灵活性,并提高了同源重组修复过程中的同源搜索速度。相关研究结果于2020年9月23日在线发表在Molecular Cell期刊上,论文标题为“DNA Damage-Induced Nucleosome Depletion Enhances Homology Search Independently of Local Break Movement”。论文通讯作者为Susan M.Gasser博士。
在这项新的研究中,Cheblal及其同事们强调,组蛋白降解和随后的染色质解压缩(chromatin decompaction)确实会提高DNA修复效率和动力学。Cheblal总结了这项研究的主要发现:“我们发现,DNA双链断裂可以通过组蛋白的受控降解引发异位的染色质解压缩[指的是在远处未受损的位点,而非局部],这对基于同源重组的DNA修复至关重要。我们还发现,局部断裂动态对DNA修复不那么重要,可以通过增加异位染色质移动来加以弥补,而异位染色质移动与染色质解压缩相关。此外,我们排除了之前的一个假设:染色体从核外周脱离是DNA损伤反应的一部分。”
当被问及这项研究的更广泛影响时,Cheblal说,“我们的研究将对CRISPR介导的基因疗法至关重要,目前这种疗法的效率太低,无法用于临床。我们的研究结果表明将这项技术与经过适当上调的因子结合起来诱导组蛋白降解,可能会提高CRISPR-Cas9的编辑效率。”
通过同源重组修复DNA是CRISPR-Cas9靶向基因组编辑的基本原理。CRISPR-Cas9编辑技术主要作为研究工具,但也用于基因治疗。初步研究表明,在哺乳动物细胞中,随着组蛋白的耗竭,CRISPR-Cas9的编辑效率可以提高。
3.Nature子刊:经改进靶向毒性RNA的CRISPR-Cas9有望治疗强直性肌营养不良I型
doi:10.1038/s41551-020-00607-7
CRISPR-Cas9是一种越来越多地用于校正导致各种疾病的基因(DNA)缺陷的技术。几年前,美国加州大学圣地亚哥医学院的研究人员改变了这种技术的作用方向:用一种他们称之为RNA靶向Cas9(RNA-targeting Cas9, RCas9)的方法来修饰RNA。
在一项新的研究中,这些研究人员证实一剂RCas9基因疗法可降解有毒的RNA,并且几乎完全逆转强直性肌营养不良小鼠模型的症状。相关研究结果于2020年9月14日在线发表在Nature Biomedical Engineering期刊上,论文标题为“The sustained expression of Cas9 targeting toxic RNAs reverses disease phenotypes in mouse models of myotonic dystrophy type 1”。

图片来自Nature Biomedical Engineering, 2020, doi:10.1038/s41551-020-00607-7。
这些研究人员将RCas9包装在一种非感染性病毒中,这种病毒载体将这种RNA切割酶递送到细胞内。他们给这些小鼠注射了单剂RCas9基因疗法或模拟治疗(mock treatment,指的是未包装RCas9的病毒载体)。RCas9将异常的重复性RNA减少了50%以上,根据组织的不同而有所变化,而且治疗后的强直性肌营养不良小鼠变得与健康小鼠基本没有区别。
4.NEJM:COVID-19快速检测有望提升准确度
doi:10.1056/NEJMc2026172
自从COVID-19大流行开始以来,麻省理工学院以及哈佛大学的研究人员,以及致力于开发基于CRISPR的COVID-19诊断程序,该程序可以在30分钟到一个小时内产生结果,其准确性与现在使用的标准PCR诊断程序相似。
该名为STOPCovid的新测试仍处于研究阶段,但原则上可以廉价地制造,人们可以每天进行自我检测。在《New England Journal of Medicine》杂志上发表的一项研究中,研究人员表明,在一组患者样本中,他们的检测发现了93%的阳性病例。
具体而言,研究人员通过添加吸引RNA的磁珠来浓缩患者样品中的病毒遗传物质,从而无需使用费时且昂贵的纯化试剂盒。由于需求量大。此浓缩步骤提高了测试的灵敏度,直到接近PCR的灵敏度。
5.Nat Biotechnol:科学家有望利用酶类测试来改善CRISPR基因编辑工具的精准性和有效性!
doi:10.1038/s41587-020-0646-5
近日,一项刊登在国际杂志Nature Biotechnology上的研究报告中,来自德克萨斯大学等机构的科学家们通过研究开发了一种新工具能帮助科学家们为特定的工作选择最佳的可用基因编辑选项,从而就使得CRISPR技术更加安全、便宜和高效。近年来,CRISPR基因编辑技术在改善人类健康、农业研究等方便表现出了巨大的潜力,但其所面临的挑战在于基因编辑的微妙性质,即不允许出错,为了实现基因编辑,科学家们会使用来自名为CRISPR的自然系统中几十种不同的酶类,随后他们会锁定出问题的DNA序列,紧接着利用酶类作为剪刀来剪断错误序列,使得遗传物质被添加、移除或改变,但这些剪刀或许并不完美,其准确性和有效性会因CRISPR酶和项目而异,而且新的工具会引导新的用户,因此研究者可以为其高风险的基因编辑选择最好的CRISPR酶类。
研究者Steve Jones博士表示,我们设计了一种新方法,其能帮助检测这些不同的CRISPR酶的特异性,其能以一种前所未有的方式来对抗任何引起DNA序列的改变;当CRISPR酶靶向作用了错误的DNA片段后问题就会出现,每一种CRISPR酶在编辑不同的序列上都会存在一定的优缺点,因此研究人员就开始着手开发一种工具来帮助科学家们比较不同的酶类并寻找你一种能发挥用途的最佳酶类。
6.Nat Cell Biol:利用CRISPR对免疫反应进行编辑,使得基因疗法更有效
doi:10.1038/s41556-020-0563-3
基因治疗一般依靠腺相关病毒(AAV)等病毒将基因递送到细胞中。在基于CRISPR的基因疗法中,分子剪刀可以移除有缺陷的基因,并添加一个缺失的序列或暂时改变它的表达,但人体对AAV的免疫反应会阻碍整个努力。

图片来自Nature Cell Biology, 2020, doi:10.1038/s41556-020-0563-3。
为了克服这一障碍,来自美国匹兹堡大学医学院的研究人员在一项新的研究中构建出一种以不同方式使用CRISPR的系统。他们的系统短暂地抑制了与AAV抗体产生有关的基因,这样这种病毒就可以不受阻碍地递送它携带的基因货物。相关研究结果近期发表在Nature Cell Biology期刊上,论文标题为“Synthetic immunomodulation with a CRISPR super-repressor in vivo”。
7.Sci Adv:新型基因疗法有望治疗遗传性失明患者
doi:10.1126/sciadv.aba5614
色素性视网膜炎是一种最常见的先天性失明症,近日,一项刊登在国际杂志Science Advances上的研究报告中,来自德国慕尼黑大学等机构的科学家们通过对色素性视网膜炎小鼠模型进行研究发现,靶向激活具有相似功能的基因或能弥补主要的缺陷。
研究者Becirovic表示,目前有两种策略用于基因疗法的开发,在基因补充的背景下,研究者会试图利用完整的基因版本来替代缺陷的基因,然而这种策略仅适用于相对较少的基因;而第二种策略的目标就是纠正诱发疾病的突变,但这通常需要针对每个单独的突变量身定做,为了克服这些困难,研究人员通过研究开发出了一种新型策略;人类基因组中的许多基因都属于某些家族,其家族成员在不同类型的细胞中发挥着相类似的功能,或者在特定细胞类型分化的过程中的不同阶段会被激活,研究人员的想法就是通过特异性地激活具有相似功能但在视网膜细胞中并不表达的基因来弥补突变基因缺失的功能,为了做到这一点,研究人员将名为Cas9-VPR的系统运输到了受影响的视网膜细胞中开始进行研究。
Cas9-VPR系统是CRISPR/Cas9技术的衍生技术,与经典的CRISPR/Cas9技术相似的是,Cas9-VPR能利用相同的靶向原则来引导激活的蛋白质进入感兴趣的特定基因位点发挥作用;随后研究者利用色素性视网膜炎小鼠模型来检测这种技术,这些小鼠模型缺乏在正常情况下能在视网膜视杆细胞中进行表达的光敏视紫红蛋白,在一种无害病毒的帮助下,研究人员将Cas9-VPR系统成功导入到了视杆细胞中,当将Cas9-VPR系统引入到小鼠的视杆细胞后,研究人员就能够开启与视紫红质基因密切相关的基因的表达,视紫质基因在负责颜色和白天视觉的视锥细胞中通常情况下处于激活状态;以这种方式,研究人员就能弥补视杆细胞中视紫红质功能的缺失,从而就能降低视网膜退行性病变的速度,并能改善视网膜的功能,从而还不对患者机体产生明显的副作用。
8.PLoS Pathog:我国科学家开发出一种快速、准确、低成本的COVID-19测试方法
doi:10.1371/journal.ppat.1008705
在一项新的研究中,来自中国广东省医学科学院、云南农业大学、中国医学科学院、北京协和医学院、复旦大学附属华山医院和徐州医科大学附属医院等研究机构的研究人员报道一种新型低成本的COVID-19测试方法可在不需要复杂设备的情况下快速提供准确的测试结果。相关研究结果于2020年8月27日发表在PLoS Pathogens期刊上,论文标题为“Development and evaluation of a rapid CRISPR-based diagnostic for COVID-19”。
在这项新的研究中,这些研究人员利用近年来广泛用于基因编辑的CRISPR技术,开发了一种替代性的COVID-19测试方法。这种被命名为CRISPR-COVID的测试方法能够高通量检测SARS-CoV-2--导致COVID-19的新型冠状病毒。CRISPR-COVID可在短短40分钟内提供与mNGS相当的灵敏度和特异性。当大规模生产时,CRISPR-COVID测试的材料成本可低于70美分,这表明CRISPR-COVID不仅在技术上,而且在财务上也是一个有竞争力的替代方案。
9.Science子刊:重大进展!移植经过CRISPR基因编辑的人棕色脂肪样细胞有望治疗肥胖和糖尿病
doi:10.1126/scitranslmed.aaz8664
肥胖是导致2型糖尿病和相关慢性疾病的主要原因,今年它在全球引起的死亡人数加起来将超过新型冠状病毒SARS-CoV-2。在一项新的研究中,来自美国哈佛医学院、中国医药大学、丹麦哥本哈根大学、新加坡国立大学、巴西圣保罗大学、韩国基础科学研究院和浦项科技大学等研究机构的研究人员针对这种危险的疾病,提出了一种新型细胞疗法的概念验证方法。相关研究结果发表在2020年8月26日的Science Translational Medicine期刊上,论文标题为“CRISPR-engineered human brown-like adipocytes prevent diet-induced obesity and ameliorate metabolic syndrome in mice”。

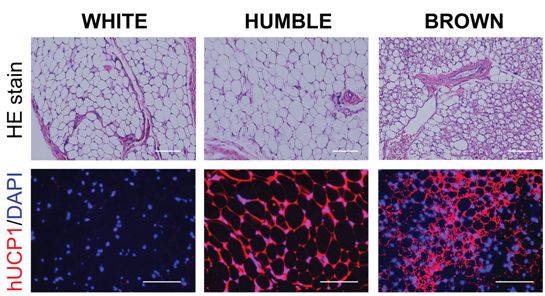
移植到小鼠体内后的各种脂肪组织的显微图。顶部的图片是各种脂肪组织的一般形态,底部的图片是用对hUCP1染色的组织切片(红色),这是棕色脂肪细胞所特有的。这些图片显示,虽然HUMBLE细胞在形态上与白色脂肪细胞相似,但是它们表达棕色脂肪特有的hUCP1蛋白。图片来自Science Translational Medicine, 2020, doi:10.1126/scitranslmed.aaz8664。
论文通讯作者、哈佛医学院乔斯林糖尿病中心的Yu-Hua Tseng博士表示,这种潜在的肥胖疗法是移植人棕色脂肪样细胞(human brown-like fat cell, HUMBLE细胞),即人类白色脂肪细胞经过基因改造后变得类似于产生热量的棕色脂肪细胞。
10.Mol Cell:中科院高彩霞课题组开发出具有高特异性和高精度的胞嘧啶碱基编辑器
doi:10.1016/j.molcel.2020.07.005
在一项新的研究中,中国科学院遗传与发育生物学研究所高彩霞(Gao Caixia)教授课题组基于截短的人APOBEC3胞嘧啶脱氨酶(A3Bctd)构建出两种新的CBE,并开发出一种高通量检测方法,用于评估植物CBE中不依赖于单向导RNA(sgRNA)的脱氨变化。相关研究结果于2020年7月27日在线发表在Molecular Cell期刊上,论文标题为“Rationally Designed APOBEC3B Cytosine Base Editors with Improved Specificity”。
他们首先开发了一种快速、高通量且廉价的方法---nSaCas9介导的正交R环测定法---来评估植物中的CBE。在这种测定法中,正交CRISPR系统nSaCas9被用于在植物细胞中产生单链DNA(ssDNA)区域,作为不依赖于sgRNA的脱氨变化的靶标。为了评估nSaCas9介导的正交R环测定,他们将它与全基因组测序(WGS)测定进行了比较。
一致性的结果表明,nSaCas9介导的正交R-loop测定法为评估CBE的不依赖于sgRNA的脱靶活性提供了一种合理、快速和高通量的方法。
他们随后通过合理设计构建出16个A3Bctd脱氨酶变体,并评估了它们的在靶效率(on-target efficiency)和不依赖于sgRNA的脱靶活性。他们利用nSaCas9介导的正交R环测定法对这些A3Bctd-BE3变体进行了测试,并选择了7个与高效的在靶编辑活性和下降的脱靶活性相关的突变。之后,他们将这些突变进行组合,产生了9个新的具有双氨基酸或三氨基酸替换的A3Bctd-BE3变体。通过这种方式,他们得到了两个新的CBE变体:A3Bctd-VHM-BE3和A3Bctd-KKR-BE3,这两个变体表现出高效的在靶活性和明显下降的不依赖于sgRNA的脱靶活性。
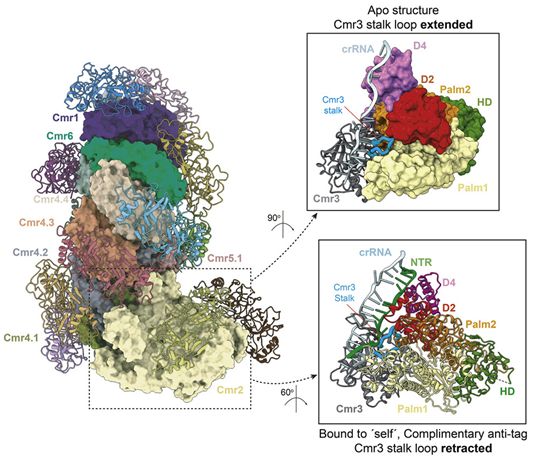
11.Mol Cell:从结构上揭示出最大最复杂的CRISPR-Cas系统的作用机制
doi:10.1016/j.molcel.2020.07.008
在一项新的研究中,来自丹麦哥本哈根大学、中国山东大学和华中农业大学的研究人员利用先进的低温电镜(CryoEM)技术成功地可视化观察最大最复杂的CRISPR-Cas系统的三维结构。他们认为这种系统可能在生物医学和生物技术方面有潜在的应用。相关研究结果于2020年7月29日在线发表在Molecular Cell期刊上,论文标题为“Structures of the Cmr-β Complex Reveal the Regulation of the Immunity Mechanism of Type III-B CRISPR-Cas”。
论文共同通讯作者、哥本哈根大学诺和诺德基金会蛋白研究中心的Guillermo Montoya教授说道,“我们解析出迄今为止所看到的最大、最复杂的CRISPR-Cas复合物的三维结构。我们如今了解了这种系统是如何在分子水平上发挥作用的。”这些研究人员研究了一种称为Cmr-β的复合物,它属于所谓的III-B型CRISPR-Cas复合物的一个亚组。
12.Science论文深度解读!基因编辑大牛揭示碱基编辑器的作用机制
doi:10.1126/science.abb1390
在短短八年内,CRISPR-Cas9已经成为基础研究和基因治疗的首选基因组编辑器。但CRISPR-Cas9也催生了其他潜在的强大DNA操纵工具,从而可能帮助修复导致遗传性疾病的基因突变。在一项新的研究中,来自美国加州大学伯克利分校的研究人员如今获得了这些最有前途的工具之一---碱基编辑器---的首个详细的三维结构,这为调整碱基编辑器使之在患者中的使用更加灵活和可控提供了一个路线图。相关研究结果发表在2020年7月31日的Science期刊上,论文标题为“DNA capture by a CRISPR-Cas9–guided adenine base editor”。

图片来自Molecular Cell, 2020, doi:10.1016/j.molcel.2020.07.008。
论文共同第一作者、加州大学伯克利分校博士后研究员Gavin Knott说,“我们第一次能够观察到碱基编辑器在发挥作用。如今,我们不仅可以了解它什么时候起作用,什么时候不起作用,而且还可以设计下一代碱基编辑器,使之变得更好、更适合于临床使用。”
论文共同第一作者、前加州大学伯克利分校博士后研究员Audrone Lapinaite(如今为亚利桑那州立大学助理教授)说,“我们实际上第一次观察到碱基编辑器作为两个独立的模块运行:一个是dCas9模块,它提供特异性;另一个是催化模块,它提供编辑活性。我们获得的这个碱基编辑器与它的靶标结合在一起时的结构真地给了我们一种思考Cas9融合蛋白的方法,总体而言,这给我们提供了dCas9的哪个区域更有利于与其他蛋白融合在一起的想法。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


