解读!揭秘肠道菌群与人类脂肪肝发生之间的密切关联!
来源:本站原创 2020-08-20 22:08
2020年8月21日 讯 /生物谷BIOON/ --近日,一项刊登在国际杂志Cell Host & Microbe上题为“Microbiota and Fatty Liver Disease—the Known, the Unknown, and the Future”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究揭示了微生物菌群与人类脂肪
2020年8月21日 讯 /生物谷BIOON/ --近日,一项刊登在国际杂志Cell Host & Microbe上题为“Microbiota and Fatty Liver Disease—the Known, the Unknown, and the Future”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究揭示了微生物菌群与人类脂肪肝发生之间的关联。
肝脏会通过门静脉、胆道系统和机体循环中的介导子与肠道进行交流,肠道中的微生物能够维持肝脏的稳态,同时还能作为特殊病原体和分子的来源从而促进脂肪肝疾病的发生,这项研究中,研究者揭示了肠道菌群的改变如何促进酒精相关和非酒精性的脂肪肝发生及进展的分子机制,这两种脂肪肝是西方国家中人群最常见的慢性肝脏疾病;研究人员阐明了肠道菌群及其产物如何诱发肝脏疾病的病理学表现,同时研究者还发现了特殊的疾病指示生物标志物,先关研究结果还有望通过操控肠道菌群来开发治疗慢性肝脏疾病的新型疗法,研究者指出,增加肠道微生物组和肝脏之间相互作用的理解或能帮助有效识别特殊疾病亚型的患者并能为患者制定出个体化的新型治疗手段。
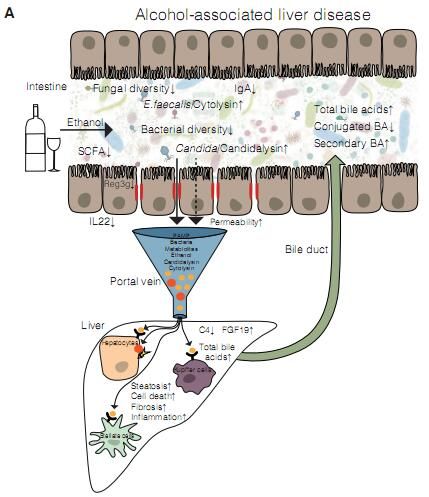
图片来源:Sonja Lang. Cell Host & Microbe 28, August 12, 2020 doi:10.1016/j.chom.2020.07.007
酒精相关的肝脏疾病(ALD)和非酒精性脂肪肝(NAFLD)是目前全球人群所面临的健康负担,近年来这两种疾病的发病率越来越高,其发病率分别为6%和25%,同时ALD和NAFLD也是西方国家最常见的慢性肝病,如今ALD是美国引发患者肝脏移植的主要原因,而且非酒精性脂肪性肝炎(NASH)也已经成为等待肝脏移植的患者中第二大常见的肝脏疾病。这篇研究报告中,研究人员阐明了肠道微生物组在ALD和NAFLD发病过程中扮演的关键角色,研究人员重点对人类机体的发病途径进行了研究,相关研究结果或有望帮助科学家们利用肠道微生物组作为诊断工具,同时采用新型策略来改变宿主的肠道微生物组从而治疗相关的肝脏疾病。
研究人类的肠道微生物组对于改善人类健康非常重要,因为啮齿类动物的肠道微生物组仅会发育出一部分人类特有的改变特征,通过将粪便移植到无菌小鼠的肠道中就能使得小鼠的肠道微生物组被人源化,这就能够帮助研究人员分析人类肠道微生物与特定疾病之间的关联,但目前的小鼠模型还存在多种重要的局限性,最重要的是,一些人群的肠道菌群无法在小鼠机体中定植,而且受体小鼠和人类供体之间的微生物群落也存在较大的差异。
此前,对人类微生物组的研究主要依赖于横断面、观察性的设计,这就是一个非常重要的不足,肠道微生物组的组成会对营养、生活方式、药物和环境状况的改变快速产生反应,而大多数研究依赖于肠道微生物组组成的单一“快照”信息,因此存在一定的重复性问题也就不足为奇了。这些问题往往限制了肠道菌群作为预后或诊断标志物的效用,此外,脂肪肝患者常常会存在一些并发症,这就会使得研究结果出现偏崎,即识别出的肠道菌群特性或会被肥胖、2型糖尿病及所使用的药物影响,因此研究人员还需要进行纵向的样本收集和更好的匹配对照研究来阐明肠道微生物菌群特征和特定障碍之间的关联,同时他们还需要随着时间对具有不同特征的大量患者的肠道菌群进行动态变化的监测,并对不同的事件作出反应,来确定肠道菌群诱发或促进肝脏疾病发生的分子机制。
除了研究与肝脏疾病相关的肠道菌群外,研究人员还需要对诸如真菌、病毒和古细菌等其它微生物进行研究,以及分析这些所有肠道菌群之间的相互作用;有证据表明,在不同的肠道环境状况下,微生物的行为往往不同,因此对微生物的研究往往可能会从分类学的描述转向对人类细胞、微生物和其代谢通路之间相互作用的功能性研究,研究人员还需要进行更为深入的研究来确定小分子代谢产物的存在和水平,以及微生物毒力因子的表达情况;所有这些方面都能更好地帮助理解肠道微生物组和肝脏疾病之间的动态相互作用。

图片来源:Sonja Lang. Cell Host & Microbe 28, August 12, 2020 doi:10.1016/j.chom.2020.07.007
目前研究人员面临的最大的挑战之一就是将ALD或NAFLD归为疾病亚群,以及是如何识别出与特定微生物组改变相关的患者,如今研究人员开发出了新方法能编辑肠道菌群,比如使用噬菌体,同时还能引入工程化的细菌来恢复特异性菌群的缺失或补充被剔除的微生物衍生的代谢产物;尽管有了这些先进的技术,目前的试验设计仍然是一刀切的,正如研究者在文章指出的那样,并非所有的患者都存在肠道屏障的功能异常,如果不依据增加肠道通透性的生物标志物来选择参与者的话,恢复肠道屏障功能的药物或许就会面临失败的下场,而基于微生物的疗法应该根据患者肠道或微生物组的特殊改变来被仔细选择。
如今个体化的疗法能够靶向作用特殊的菌群来增加疗法的效力或降低副作用等,NAFLD患者或许并不太可能会增加内源性乙醇的产生或增加胆汁酸的合成,因此,不仅要报告整个患者群体的检测结果平均值,而且要根据微生物、遗传和代谢特性(或其组合)来将患者归入亚群,这一点非常重要,因为这些标志物能帮助研究人员识别出ALD和NAFLD存在进展风险的患者,并能选择合适的治疗性手段。
理解肠道微生物和人类之间的多种复杂关系或有望帮助开发出新型非侵入性的诊断和预后策略,同时还能帮助开发个体化基于微生物的疾病治疗手段,似乎目前科学家们不知道的远比他们真正了解地要多,因此后期他们还将继续深入研究阐明肠道菌群与多种人类疾病发生之间的密切关联。(生物谷Bioon.com)
参考资料:
Sonja Lang,Bernd Schnab. Microbiota and Fatty Liver Disease—the Known, the Unknown, and the Future, Cell Host & Microbe 28, August 12, 2020 doi:10.1016/j.chom.2020.07.007
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


