杜氏肌营养不良(DMD)新药!美国FDA批准第二款53号外显子跳跃疗法Viltepso!
来源:本站原创 2020-08-13 13:04
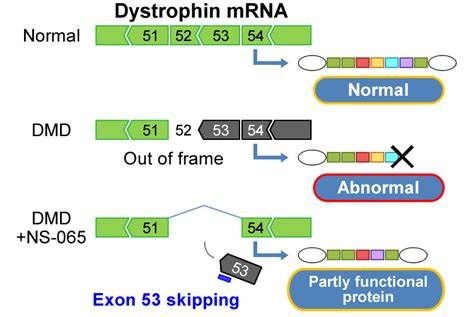
Viltepso是一种反义寡核苷酸药物,通过跳过第53号外显子发挥作用。

2020年08月13日讯 /生物谷BIOON/ --日本新药株式会社(Nippon Shinyaku)子公司NS Pharma近日宣布,美国食品和药物管理局(FDA)已批准Viltepso(viltolarsen),用于经基因检测证实存在突变、适合使用跳过第53号外显子(exon 53 skipping)治疗的杜氏肌营养不良症(DMD)患者,这类患者约占DMD患者总数的8%。今年3月,Viltepso在日本获得批准。用药方面,Viltepso通过静脉输注给药,每周一次,剂量为80mg/kg,可在家/医院/治疗中心,由训练有素的专业医护人员进行给药。
Viltepso是美国FDA批准的第二款治疗DMD的第53号外显子跳过疗法。2019年底,Sarepta公司药物Vyondys 53(golodirsen)获得FDA批准。2款药物均为反义寡核苷酸药物,作用机制相同,通过屏蔽(跳跃)抗肌萎缩蛋白(抗肌萎缩蛋白,Dys)基因中的外显子53来促进功能性抗肌萎缩蛋白的产生。
基于抗肌萎缩蛋白(Dys,一种支持肌肉健康的关键蛋白)水平的增加,Viltepso获得了FDA的加速批准。由于抗肌萎缩蛋白缺乏是导致DMD的根本原因,因此尽可能早地增加抗肌萎缩蛋白水平是治疗DMD的一个关键目标。
值得一提的是,Viltepso是第一个也是唯一一个被证实在年龄低至4岁的儿童中可增加抗肌萎缩蛋白水平的第53号外显子跳过疗法。Viltepso的持续批准将取决于在III期验证性临床试验中是否有临床益处。
Viltepso在2项临床研究中进行了评估,共涉及32例DMD男性患者。其中一项是在北美对4岁至10岁以下DMD男孩开展的两个周期II期研究(研究1,n=16);另一项是在日本对5岁至18岁以下DMD男孩开展的多中心开放标签研究(研究2,n=16)。
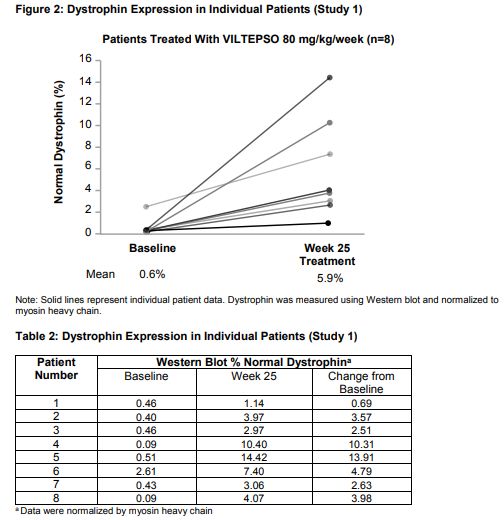
抗肌萎缩蛋白水平的增加在研究1中进行了确认。该研究中,在接受推荐剂量80mg/kg/wk(N=8)的患者中,100%的患者(8/8)在使用Viltepso治疗后显示抗肌萎缩蛋白水平增加,88%的患者(7/8)抗肌萎缩蛋白水平达到正常值的3%或更高。总体而言,在基线检查时,患者抗肌萎缩蛋白水平为正常值的0.6%,而在接受Viltepso(80 mg/kg/wk)治疗20-24周后,观察到患者抗肌萎缩蛋白水平增加到正常值的6%。安全性方面,接受每周一次Viltepso(80 mg/kg/wk)治疗的DMD患者(合并2项研究),最常见的副作用包括上呼吸道感染、注射部位反应、咳嗽和发热。
FDA的结论是,申请人的数据表明,在DMD患者中,抗肌萎缩蛋白的产量增加,这有可能合理地预测Viltepso在经基因检测证实存在突变适合使用跳过第53号外显子治疗的DMD患者中的临床益处。该药的临床疗效尚未证实。在做出这一决定时,FDA考虑了与该药相关的潜在风险、该病的致命性和衰弱性以及缺乏可用的治疗方法。
作为加速审批程序的一部分,FDA要求NS Pharma进行临床试验,以确认该药物的临床益处。这项正在进行的研究旨在评估Viltepso是否能提高DMD患者的站立时间。如果试验未能验证临床疗效,FDA可能会启动程序撤销对该药物的批准。
虽然Viltepso临床研究中未观察到肾毒性,但Viltepso的临床经验有限,在给药一些反义寡核苷酸后,已经观察到肾毒性,包括潜在的致命性肾小球肾炎。服用Viltepso的患者应监测肾功能。

DMD儿童(图片来源:University of Florida)
杜氏肌营养不良(DMD)是一种罕见的致命性神经肌肉遗传病,其特点是进行性肌肉退化和无力,该病是最常见的一种肌营养不良症。DMD是由DMD基因中的突变引起的,导致肌营养不良蛋白的缺失。该病最初的症状通常在3-5岁出现,并随着时间的推移而恶化。
DMD患者在2岁时就会出现进行性和不可逆的肌肉丢失症状。心脏和呼吸肌问题始于青少年时期,会导致严重的危及生命的并发症。该病是普遍致命的,患者通常在20多岁时死亡。在全世界,大约每3600名男婴中就有一名患DMD;在极少数情况下,它也会影响女性。
Sarepta是利用“外显子跳过疗法”治疗DMD的行业领导者。截至目前,该公司已有2款DMD跳过疗法获得了美国FDA的批准:(1)2016年,Exondys 51(eteplirsen)获得批准,用于治疗经检测证实适合使用跳过第51号外显子(exon 51 skipping)治疗的DMD患者,这类患者约占DMD患者总数的12%。(2)2019年,Vyondys 53(golodirsen)获得批准,用于治疗经检测证实适合使用跳过第53号外显子(exon 53 skipping)治疗的DMD患者,这类患者约占DMD患者总数的8%。
目前,Sarepta公司第三款DMD跳过疗法casimersen也正在接受FDA的审查,该疗法专门为治疗适合跳过第45号外显子的DMD患儿而设计的,这类患者约占DMD患者总数的8%。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


