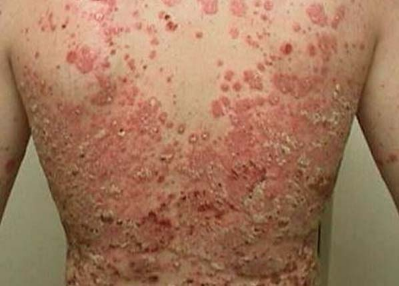
斑块型银屑病外用新药!美国FDA批准Wynzora(钙泊三醇/二丙酸倍他米松)乳膏剂!
来源:本站原创 2020-07-24 16:20
在III期临床中,Wynzora疗效优于Taclonex外用混悬剂。与赋形剂相比,可显著减轻瘙痒。

2020年07月24日讯 /生物谷BIOON/ --MC2 Therapeutics是一家专注于开发慢性炎症局部治疗新标准的商业制药公司。近日,该公司宣布,美国食品和药物管理局(FDA)已批准Wynzora乳膏(钙泊三醇和二丙酸倍他米松,w/w,0.005%/0.064%),作为每日一次的外用疗法,用于≥18岁成人治疗斑块型银屑病。最近,该公司也在欧盟提交了Wynzora乳膏剂治疗成人斑块型银屑病的营销授权申请(MAA)。
Wynzora乳膏剂是一种基于乳膏的钙泊三醇和二丙酸倍他米松的固定剂量组合产品,用于局部治疗斑块状银屑病。Wynzora乳膏剂基于PAD技术,该技术独特地使钙泊三烯和二丙酸倍他米松在方便使用的水性制剂中具有稳定性。在美国和欧盟多个临床中心开展的III期试验中,Wynzora乳膏展示了令人信服的临床疗效、良好的安全性和高度便利性的独特组合。Wynzora乳膏剂的这些特点有望在真实环境下局部治疗斑块性银屑病时减少治疗中断,提高患者整体满意度。
用药方面,Wynzora涂抹于患处,每天一次,持续8周,每周不超过100克。当斑块型银屑病得到控制时,患者应停止治疗。除非医生给出其他指示。Wynzora乳膏仅用于皮肤(局部)。

此次FDA批准,基于一项美国III期试验的结果。该试验将Wynzora乳膏剂与阳性对照药物Taclonex外用混悬剂(钙泊三醇和二丙酸倍他米松,w/w,0.005%/0.064%)进行了比较。试验中共794例患者被随机分组,主要疗效终点是治疗第8周采用医生整体评估(PGA)确认治疗成功的患者比例,定义为PGA从基线改善至少2级至、达到皮损“完全清除”或“几乎完全清除”。
数据显示,与Taclonex对照组相比,Wynzora治疗组PGA成功率提高了14.6%(95%CI:7.6%,21.6%;p<0.0001)。此外,从基线检查至治疗第4周,由11分峰值瘙痒数值评定量表(NRS)至少改善4分所定义的瘙痒减轻方面,Wynzora组瘙痒减轻的患者比例显著高于无药赋形剂组(60.3% vs 21.4%)。
该研究的首席研究员、密歇根州底特律亨利福特健康系统皮肤病临床研究主任Linda Stein Gold博士表示:“Wynzora乳膏剂是一种新型的斑块型银屑病局部治疗方法,它在单一产品中提供了高效、安全和极好的治疗便利性的独特组合。”
MC2公司首席执行官Jesper J.Lange表示:“FDA的批准标志着斑块状银屑病患者的一个重要里程碑。我们的PAD技术使我们能够毫无妥协地开发Wynzora®面霜。它推动了Wynzora®乳膏令人信服的功效和安全性数据,并通过方便的配方将这些数据转化为对患者的影响,使患者能够在早晨的常规治疗后几分钟内继续进行治疗。它让患者重新掌控治疗和日常生活。”(生物谷Bioon.com)
原文出处:MC2 Therapeutics Announces U.S. Food and Drug Administration approval of Wynzora Cream (calcipotriene and betamethasone dipropionate w/w 0.005%/0.064%) for Adults with Plaque Psoriasis
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


