治疗阿尔茨海默(AD)激越!美国FDA授予AXS-05(右美沙芬/安非他酮调释剂)突破性药物资格!
来源:本站原创 2020-06-28 01:30
目前,尚无治疗AD激越的药物,II/III期临床显示,AXS-05可快速、实质性、显著改善AD激越。

2020年06月27日讯 /生物谷BIOON/ --Axsome Therapeutics是一家临床阶段的生物制药公司,专注于开发治疗中枢神经系统(CNS)疾病的创新疗法。近日,该公司宣布,美国食品和药物管理局(FDA)已授予AXS-05(右美沙芬/安非他酮调释剂)突破性药物资格(BTD),用于治疗阿尔茨海默氏症(AD)激越(agitation)。目前,尚无药物被批准用于治疗AD激越。
BTD是FDA在2012年创建的一个新药评审通道,旨在加快开发及审查用于治疗严重或威及生命的疾病并且有初步临床证据表明该药与现有治疗药物相比能够实质性改善病情的新药。获得BTD的药物,在研发时能得到包括FDA高层官员在内的更加密切的指导,保障在最短时间内为患者提供新的治疗选择。
阿尔茨海默氏症(AD)是最常见的痴呆症类型,其特点是认知能力下降,行为和心理症状包括躁动。在70%的AD患者中可观察到激越,这与认知能力的加速下降、养老院的早期安置和死亡率的增加有关。临床研究显示,与安慰剂相比,AXS-05可快速、实质性、显著改善AD患者的激越。
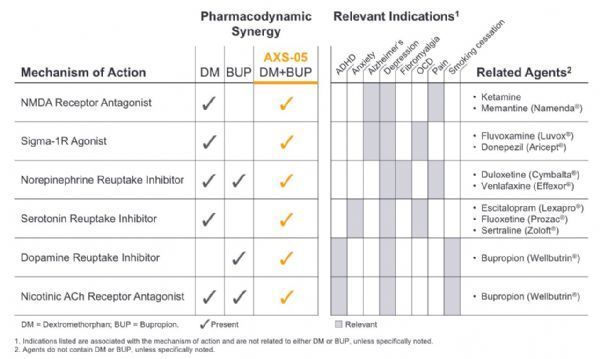
AXS-05是一种新型、口服、专有的NMDA受体拮抗剂,具有多模式活性,目前正处于临床开发,用于治疗抑郁症和其他中枢神经系统(CNS)疾病。AXS-05由右美沙芬(dextromethorphan)和安非他酮(bupropion)的专有配方和剂量组成,并采用了Axsome公司的代谢抑制技术。
AXS-05的右美沙芬组分是一种非竞争性N-甲基-D-天冬氨酸(NMDA)受体拮抗剂,也被称为谷氨酸受体调节剂,这是一种新的作用机制,这意味着它的作用与目前可用的大多数抑郁症药物不同。AXS-05的右美沙芬组分也是一种sigma-1受体激动剂、烟碱乙酰胆碱受体拮抗剂、血清素和去甲肾上腺素转运体抑制剂。AXS-05的安非他酮成分可提高右美沙芬的生物利用度,是一种去甲肾上腺素和多巴胺再摄取抑制剂和一种烟碱乙酰胆碱受体拮抗剂。AXS-05拥有40多项美国和国际专利,保护期直至2034年。
目前,AXS-05已在阿尔茨海默激越、抑郁症、戒烟试验中证明了其有效性。此外,AXS-05在阿尔茨海默激越和抑郁症中与阳性药物和安慰剂对照组相比均显示出快速起效。
Axsome首席执行官Herriot Tabuteau医学博士表示:“此次BTD是开发AXS-05治疗AD激越的一个重要里程碑。AD激越是一种严重、普遍和衰弱的疾病,目前还没有批准的治疗方案。此次也是AXS-05获得的第二个BTD,强调了AXS-05在解决多个难以治疗的中枢神经系统疾病中未满足医疗需求方面的潜力。我们期待着在未来几个月与FDA合作,推进AXS-05治疗AD激越的研发。”
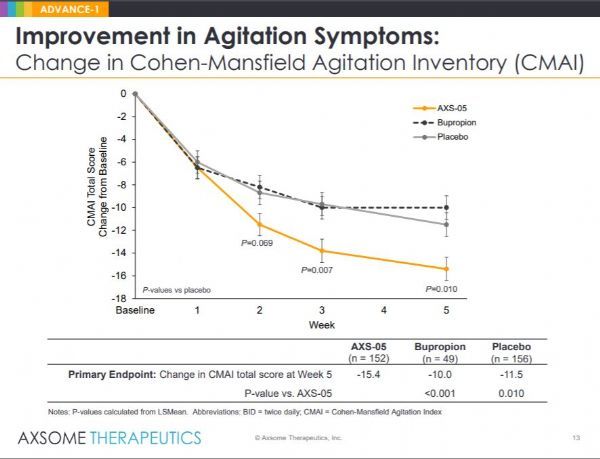
此次BTD,基于II/III期ADVANCE-1研究的数据。这是一项随机、双盲、对照、多中心、美国试验,旨在评估AXS-05治疗AD激越的疗效和安全性。该研究中,有366例患者随机接受AXS-05(剂量递增至45mg/105mg,每天2次)、安非他酮(剂量递增至105mg,每日2次)、安慰剂,持续治疗5周。主要疗效指标是柯恩-曼斯菲尔德激越情绪行为量表(CMAI,简称柯氏量表)。CMAI是一个由29项照顾者评定的量表,用于评估痴呆患者与激越相关的行为的频率,包括过度的运动活动(如踱步不安)、言语攻击(如尖叫和喊叫)和身体攻击(如抓、推和打)。
今年4月底,Axsome公司宣布,ADVANCE-1试验达到了主要终点。数据显示,在第5周,与安慰剂组相比,AXS-05组患者CMAI总分在统计学上显著降低:AXS-05组从基线平均降低15.4分、安慰剂组平均降低11.5分(p=0.010)。这些结果代表着,AXS-05组的平均百分比从基线水平降低为48%,而安慰剂组的平均百分比降低为38%。AXS-05在CMAI总分上也优于安非他酮(p<0.001),证实了药物中的右美沙芬成分的贡献。
AXS-05能迅速改善激越症状。从第2周开始AXS-05对CMAI总分的改善在数值上优于安慰剂,仅在使用AXS-05完整剂量后一周即第3周达到统计学显著性(p=0.007)。
与安慰剂组相比,AXS-05组患者在CMAI方面获得临床应答的比例(73% vs 57%,p=0.005)在统计学上显著增加,临床应答定义为较基线水平提高30%或更高。这些结果与临床医生使用改良的阿尔茨海默病协作研究-临床改变总体印象量表(mADCS-CGIC)测量的整体评估变化一致。与安慰剂相比,AXS-05显示出在统计学上显著改善激越(p=0.036)。
该试验中,AXS-05的耐受性良好。AXS-05组最常见的不良反应为嗜睡(AXS-05组为8.2%,安非他酮组为4.1%,安慰剂组为3.2%)、头晕(分别为6.3%,10.2%,3.2%)和腹泻(分别为4.4%,6.1%,4.4%)。在AXS-05、安非他酮和安慰剂组中,因不良事件而停药的比率分别为1.3%、2.0%和1.3%。在接受AXS-05治疗的患者中,3.1%的患者出现严重不良事件,而安非他酮和安慰剂治疗的患者分别为8.2%和5.7%。任何治疗组均未发现与研究药物相关的严重不良事件。安慰剂组有1例死亡,安非他酮组有1例死亡,AXS-05组无1例死亡。小型精神状态检查(MMSE)是一种广泛应用的一般认知功能测量方法,没有证据显示接受AXS-05治疗的患者认知能力下降。AXS-05治疗与镇静无关。(生物谷Bioon.com)
原文出处:Axsome Therapeutics Receives FDA Breakthrough Therapy Designation for AXS-05 for the Treatment of Alzheimer’s Disease Agitation
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->