Science:经过CRISPR基因编辑的CAR-T细胞在癌症患者体内是安全的
来源:本站原创 2020-02-07 14:45
2020年2月7日讯/生物谷BIOON/---在一项新的研究中,来自美国宾夕法尼亚大学和斯坦福大学的研究人员将两种最先进的方法---CRISPR(对DNA进行编辑)和T细胞疗法(利用免疫系统的哨兵破坏肿瘤)---结合在一起,从而在快速发展的癌症免疫疗法领域开创了新的篇章。他们报道两名女性和一名男性,年龄都在60多年,其中的一人患有肉瘤,剩余两人患有一种称为多
2020年2月7日讯/生物谷BIOON/---在一项新的研究中,来自美国宾夕法尼亚大学和斯坦福大学的研究人员将两种最先进的方法---CRISPR(对DNA进行编辑)和T细胞疗法(利用免疫系统的哨兵破坏肿瘤)---结合在一起,从而在快速发展的癌症免疫疗法领域开创了新的篇章。他们报道两名女性和一名男性,年龄都在60多年,其中的一人患有肉瘤,剩余两人患有一种称为多发性骨髓瘤的血癌。这三名患者在去年接受了他们自身的经过CRISPR基因编辑的免疫细胞治疗。相关研究结果于2019年2月6日在线发表在Science期刊上,论文标题为“CRISPR-engineered T cells in patients with refractory cancer”。
对这三名患者来说,益处是有限的:一人已经死亡,而另外两人的病情已经恶化。但是,论文通讯作者、宾夕法尼亚大学癌症研究员Carl June说,这项经过多年监管审查的临床试验并不是为了治愈癌症,相反,它的目标是表明这种策略是可行的和安全的。
就这一指标而言,科学家们同意,它成功了。美国加州大学伯克利分校基因组编辑学者Fyodor Urnov(未参与这项研究)说,“这是一个决定性的转折点。”他说,这项研究在美国尚属首次,解答了“明显困扰了这个领域的问题”。
这些研究人员将CRISPR与另一种将新DNA整合到免疫细胞中的策略组合使用。June及其团队在2010年帮助开创了这一策略,当时他们将DNA添加到来自三名男性慢性白血病患者的T细胞中,并将这些T细胞灌注回相同的患者体内。治疗结果是了不起的:两名男性患者如今仍然活着并且保持健康。其他人正在测试这种相同的称为CAR-T细胞疗法的方法---导入到T细胞中的嵌合抗原受体(CAR)基因有助于这些灌注回到患者体内的T细胞结合并摧毁表面上表达特定蛋白的癌细胞。制备CAR-T细胞的过程通常需要4到6周的时间。如今,已有两款CAR-T细胞疗法被批准用于治疗白血病患者和淋巴瘤患者。
但是随着时间的流逝,这种疗法的局限性逐渐成为人们关注的焦点。论文第一作者、在宾夕法尼亚大学治疗血液癌症的Edward Stadtmauer说,并不是每名癌症患者都会受益,即便那些受益的癌症患者也会复发。脑瘤和胰腺瘤等实体瘤已被证实很难治疗。
人们希望使用CRISPR敲除选定的基因,同时添加DNA,这可能会让T细胞变得更加强大和持久。但是CRISPR带来了它自己的不确定性。实验室研究显示出它存在“脱靶”效应,即意想不到的DNA修饰。没有人知道携带经过编辑的基因的T细胞是否还能在人体中存活。去年,Vertex Pharmaceuticals公司和CRISPR Therapeutics公司宣布,两名接受经过CRISPR编辑的细胞治疗的遗传性血液病患者表现良好,但是未公布太多的细节。
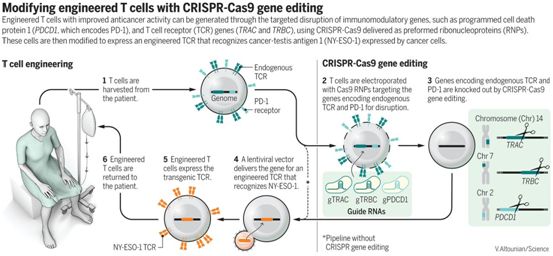
June、Stadtmauer和他们的同事们先是寻找那些所患的肿瘤产生一种名为NY-ESO-1的蛋白的患者,以便将一个编码靶向这种蛋白的基因添加到从这些患者体内提取出的T细胞中。这些患者也需要携带一种特定类型的人类白细胞抗原(HLA),HLA是一种免疫蛋白复合物,有助于灌注回患者体内的T细胞茁壮成长。符合条件的四名患者都病得很重,这是这种新疗法经常遇到的情形。一名患有多发性骨髓瘤的女性患者接受了三次骨髓移植。另一名在三十多岁时患上肉瘤的女性患者病情太重无法接受她的在实验室中经过基因改造的T细胞治疗,她接受临床关怀,死了。
为了促进来自这些患者的T细胞抵抗他们所患的疾病,这些研究人员使用CRISPR敲除了两个编码所谓T细胞受体(TCR)的基因。此外,他们还削弱了第三个基因,它编码一种称为PD-1的蛋白。June团队推测,PD-1可以阻止免疫反应,清除PD-1的影响可能会丰富T细胞的功能。随后,他们将一个不同的靶向NY-ESO-1的T细胞受体编码基因插入到T细胞中。
对这三名患者的密集监测,包括抽血以研究他们体内的经过基因改造的T细胞,结果证实了CRISPR会导致一些脱靶变化。但是它们很少,而且具有这些意想不到的DNA变化的细胞数量会随着时间的推移逐渐消失。令人鼓舞的是,这些经过CRISPR基因编辑的T细胞可在体内持续至少9个月的时间,而现有的CAR-T细胞疗法研究中,这一数字为大约2个月。June说,影像学检查显示出“良好的健康的T细胞”,在实验室研究中,它们在输注回患者体内几个月后就可以击退癌症。
但在这三名患者中,预后却不高。最好的反应是在一名肉瘤患者体内观察到的,他的原发性肿瘤缩小了,不过他的癌症后来又恶化了。美国加州大学洛杉矶分校肿瘤学家Antoni Ribas说,“这不像是你关闭了这些基因,这些T细胞就会开始发挥惊人的作用。”Ribas、June和其他人提出了可能的原因,包括接受治疗的患者人数较少,以NY-ESO-1为靶标可能存在局限性(选择它作为靶标部分上是出于它具有较好的安全记录)以及未能在许多T细胞中敲除全部的三个基因。
这篇论文的一些作者正在与公司合作将这种方法商业化。但是,未来还有很多实验需要开展。 Stadtmauer说,“这整个领域充满了不同的想法。”其他的一些临床试验,包括在中国开展的一些临床试验,正在为患有癌症或其他疾病的患者提供经过CRISPR基因编辑的细胞。在Ribas的协助下成立的PACT Pharma公司正在开展一项利用CRISPR靶向实体瘤中的基因突变的临床试验。
Ribas说,June团队为给患者给送经过CRISPR基因编辑的T细胞提供了“一个必要的开端”。他补充道,从现在开始,“事情将变得更加简单,这是因为他们首先这样做了。”(生物谷 Bioon.com)
参考资料:
1.Cutting-edge CRISPR gene editing appears safe in three cancer patients
https://www.sciencemag.org/news/2020/02/cutting-edge-crispr-gene-editing-appears-safe-three-cancer-patients
2.Edward A. Stadtmauer et al. CRISPR-engineered T cells in patients with refractory cancer. Science, 2020, doi:10.1126/science.aba7365.
3.Jennifer Couzin-Frankel. CRISPR takes on cancer. Science, 2020, doi:10.1126/science.367.6478.616.
4.Jennifer R. Hamilton et al. Knocking out barriers to engineered cell activity. Science, 2020, doi:10.1126/science.aba9844.

图片来自Science, 2020, doi:10.1126/science.aba9844。
对这三名患者来说,益处是有限的:一人已经死亡,而另外两人的病情已经恶化。但是,论文通讯作者、宾夕法尼亚大学癌症研究员Carl June说,这项经过多年监管审查的临床试验并不是为了治愈癌症,相反,它的目标是表明这种策略是可行的和安全的。
就这一指标而言,科学家们同意,它成功了。美国加州大学伯克利分校基因组编辑学者Fyodor Urnov(未参与这项研究)说,“这是一个决定性的转折点。”他说,这项研究在美国尚属首次,解答了“明显困扰了这个领域的问题”。
这些研究人员将CRISPR与另一种将新DNA整合到免疫细胞中的策略组合使用。June及其团队在2010年帮助开创了这一策略,当时他们将DNA添加到来自三名男性慢性白血病患者的T细胞中,并将这些T细胞灌注回相同的患者体内。治疗结果是了不起的:两名男性患者如今仍然活着并且保持健康。其他人正在测试这种相同的称为CAR-T细胞疗法的方法---导入到T细胞中的嵌合抗原受体(CAR)基因有助于这些灌注回到患者体内的T细胞结合并摧毁表面上表达特定蛋白的癌细胞。制备CAR-T细胞的过程通常需要4到6周的时间。如今,已有两款CAR-T细胞疗法被批准用于治疗白血病患者和淋巴瘤患者。
但是随着时间的流逝,这种疗法的局限性逐渐成为人们关注的焦点。论文第一作者、在宾夕法尼亚大学治疗血液癌症的Edward Stadtmauer说,并不是每名癌症患者都会受益,即便那些受益的癌症患者也会复发。脑瘤和胰腺瘤等实体瘤已被证实很难治疗。
人们希望使用CRISPR敲除选定的基因,同时添加DNA,这可能会让T细胞变得更加强大和持久。但是CRISPR带来了它自己的不确定性。实验室研究显示出它存在“脱靶”效应,即意想不到的DNA修饰。没有人知道携带经过编辑的基因的T细胞是否还能在人体中存活。去年,Vertex Pharmaceuticals公司和CRISPR Therapeutics公司宣布,两名接受经过CRISPR编辑的细胞治疗的遗传性血液病患者表现良好,但是未公布太多的细节。
June、Stadtmauer和他们的同事们先是寻找那些所患的肿瘤产生一种名为NY-ESO-1的蛋白的患者,以便将一个编码靶向这种蛋白的基因添加到从这些患者体内提取出的T细胞中。这些患者也需要携带一种特定类型的人类白细胞抗原(HLA),HLA是一种免疫蛋白复合物,有助于灌注回患者体内的T细胞茁壮成长。符合条件的四名患者都病得很重,这是这种新疗法经常遇到的情形。一名患有多发性骨髓瘤的女性患者接受了三次骨髓移植。另一名在三十多岁时患上肉瘤的女性患者病情太重无法接受她的在实验室中经过基因改造的T细胞治疗,她接受临床关怀,死了。
为了促进来自这些患者的T细胞抵抗他们所患的疾病,这些研究人员使用CRISPR敲除了两个编码所谓T细胞受体(TCR)的基因。此外,他们还削弱了第三个基因,它编码一种称为PD-1的蛋白。June团队推测,PD-1可以阻止免疫反应,清除PD-1的影响可能会丰富T细胞的功能。随后,他们将一个不同的靶向NY-ESO-1的T细胞受体编码基因插入到T细胞中。
对这三名患者的密集监测,包括抽血以研究他们体内的经过基因改造的T细胞,结果证实了CRISPR会导致一些脱靶变化。但是它们很少,而且具有这些意想不到的DNA变化的细胞数量会随着时间的推移逐渐消失。令人鼓舞的是,这些经过CRISPR基因编辑的T细胞可在体内持续至少9个月的时间,而现有的CAR-T细胞疗法研究中,这一数字为大约2个月。June说,影像学检查显示出“良好的健康的T细胞”,在实验室研究中,它们在输注回患者体内几个月后就可以击退癌症。
但在这三名患者中,预后却不高。最好的反应是在一名肉瘤患者体内观察到的,他的原发性肿瘤缩小了,不过他的癌症后来又恶化了。美国加州大学洛杉矶分校肿瘤学家Antoni Ribas说,“这不像是你关闭了这些基因,这些T细胞就会开始发挥惊人的作用。”Ribas、June和其他人提出了可能的原因,包括接受治疗的患者人数较少,以NY-ESO-1为靶标可能存在局限性(选择它作为靶标部分上是出于它具有较好的安全记录)以及未能在许多T细胞中敲除全部的三个基因。
这篇论文的一些作者正在与公司合作将这种方法商业化。但是,未来还有很多实验需要开展。 Stadtmauer说,“这整个领域充满了不同的想法。”其他的一些临床试验,包括在中国开展的一些临床试验,正在为患有癌症或其他疾病的患者提供经过CRISPR基因编辑的细胞。在Ribas的协助下成立的PACT Pharma公司正在开展一项利用CRISPR靶向实体瘤中的基因突变的临床试验。
Ribas说,June团队为给患者给送经过CRISPR基因编辑的T细胞提供了“一个必要的开端”。他补充道,从现在开始,“事情将变得更加简单,这是因为他们首先这样做了。”(生物谷 Bioon.com)
参考资料:
1.Cutting-edge CRISPR gene editing appears safe in three cancer patients
https://www.sciencemag.org/news/2020/02/cutting-edge-crispr-gene-editing-appears-safe-three-cancer-patients
2.Edward A. Stadtmauer et al. CRISPR-engineered T cells in patients with refractory cancer. Science, 2020, doi:10.1126/science.aba7365.
3.Jennifer Couzin-Frankel. CRISPR takes on cancer. Science, 2020, doi:10.1126/science.367.6478.616.
4.Jennifer R. Hamilton et al. Knocking out barriers to engineered cell activity. Science, 2020, doi:10.1126/science.aba9844.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


