非阿片类止痛药!Baudax Bio静脉注射meloxicam(美洛昔康)治疗中重度疼痛在美国迎来监管逆转!
来源:本站原创 2020-01-24 11:17
2020年01月24日讯 /生物谷BIOON/ --Baudax Bio是一家专注于急性护理治疗的专业制药公司。近日,该公司宣布,美国食品和药物管理局(FDA)已将meloxicam(美洛昔康)静脉注射液(IV)治疗中度至重度疼痛的新药申请(NDA)的处方药用户收费法(PDUFA)目标日期定为2020年2月20日。去年3月,FDA发布一份完整回应函(CRL)

2020年01月24日讯 /生物谷BIOON/ --Baudax Bio是一家专注于急性护理治疗的专业制药公司。近日,该公司宣布,美国食品和药物管理局(FDA)已将meloxicam(美洛昔康)静脉注射液(IV)治疗中度至重度疼痛的新药申请(NDA)的处方药用户收费法(PDUFA)目标日期定为2020年2月20日。
去年3月,FDA发布一份完整回应函(CRL),拒绝批准meloxicam(30mg)IV用于中度至重度疼痛管理。这也是该药第二次被FDA拒绝批准,之前的一次是在2018年5月,当时给出的原因是在事后分析和所选定的次要终点中显示出的镇痛效果不符合该机构的预期。去年3月的CRL中,FDA的关注点继续集中在meloxicam IV的起效和持续时间,指出延迟起效不能满足处方者对IV药物的期望;基于FDA对临床试验数据的解读,CRL还提到了有关meloxicam IV作为急性疼痛单药疗法的作用以及如何满足患者和处方者在该治疗环境下需求的监管关注。
去年10月,Baudax(通过其前母公司Recro Pharma)收到了FDA的裁决书,允许该公司对2019年3月收到的CRL进行上诉。之后,Baudax提交了上诉申请。此次PDUFA目标日期分配,是在FDA受理了Baudax最新的完整应对方案的基础上做出的。
Baudax Bio总裁兼首席执行官Gerri Henwood说表示:“我们很高兴FDA受理了我们最新的应对方案,我们相信这将解决该机构的担忧,其中包括静脉注射meloxicam单独或联合其他止痛药用于治疗中度至重度疼痛的拟议标签。我们将与FDA密切合作。”
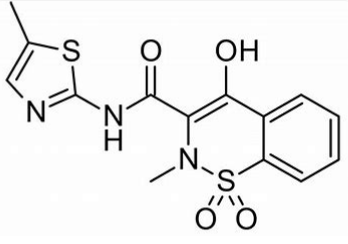
meloxicam分子结构式(图片来源:Wikipedia)
目前,疼痛市场市值59亿美元,由阿片类药物主导,非阿片类止痛产品是患者和医生在多种临床环境下安全有效地管理疼痛的重要工具。
meloxicam IV属于非阿片类药物,据认为可以克服常规处方阿片类药物的许多相关问题,包括呼吸抑制、便秘、过度恶心和呕吐,可避免成瘾滥用,同时维持有意义的止痛效果。
Baudax Bio公司坚信,meloxicam IV在多种临床环境中作为中重度疼痛治疗选择具有巨大的潜力,这款非阿片类止痛产品如果上市,将帮助解决目前美国面临的严重阿片流行危机。
特别值得一提的是,就在最近,美国FDA麻醉和镇痛药物产品咨询委员会(AADPAC)和药物安全和风险管理咨询委员会(DSaRM)以27:0的投票结果,全票反对批准Nektar Therapeutics公司的阿片类止痛药NKTR-181(oxycodegol,PEG化羟考酮)。基于该投票结果,Nektar Therapeutics公司已决定撤回NKTR-181的新药申请(NDA),不再对该项目进行投资。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


