胆汁酸功能多多,你知道哪些?
来源:本站原创 2020-01-11 17:09
2020年1月11日讯/生物谷BIOON/---胆汁酸是胆汁的重要成分,在脂肪代谢中起着重要作用。 胆汁酸主要存在于肠肝循环系统并通过再循环起一定的保护作用。只有一少部分胆汁酸进入外围循环。促进胆汁酸肠肝循环的动力是肝细胞的转运系统---吸收胆汁酸并将其分泌入胆汁、缩胆囊素诱导的胆囊收缩、小肠的推进蠕动,回肠黏膜的主动运输及血液向门静脉的流入。目前在动物医学
2020年1月11日讯/生物谷BIOON/---胆汁酸是胆汁的重要成分,在脂肪代谢中起着重要作用。 胆汁酸主要存在于肠肝循环系统并通过再循环起一定的保护作用。只有一少部分胆汁酸进入外围循环。
促进胆汁酸肠肝循环的动力是肝细胞的转运系统---吸收胆汁酸并将其分泌入胆汁、缩胆囊素诱导的胆囊收缩、小肠的推进蠕动,回肠黏膜的主动运输及血液向门静脉的流入。
目前在动物医学界很多专家对此进行研究,研究发现胆汁酸在动物机体内乳化脂肪扩大与脂肪酶的接触面积;调控胰脂肪酶和脂蛋白酯酶的活性提高其对脂肪的水解代谢;在肠道内转运脂肪,促进脂肪的吸收。另外,胆汁酸通过调控激素敏感脂肪酶的活性,明显减少了自体脂肪的分解代谢。综上所述,胆汁酸能够节约能量原料,提高能量利用率,改善生长性能及屠宰性能,是节约资源的“正能量”。
基于此,小编针对胆汁酸近年来取得的进展进行一番盘点,以飨读者。
1.两篇Nature揭示胆汁酸在调节肠道免疫和肠道炎症中起关键作用
doi:10.1038/s41586-019-1785-z; doi:10.1038/s41586-019-1865-0
胆汁是由肝脏和胆囊产生的汁液。胆汁中的胆汁酸能够溶解脂肪,它们还可能在免疫反应和炎症中起作用吗?根据美国哈佛医学院开展的两项独立的研究,答案似乎是肯定的。这两项以小鼠为实验对象的研究发现胆汁酸可促进几种参与调节炎症并且与肠道炎症性疾病相关的几种类型的T细胞的分化和活性。它们还揭示肠道微生物对于将胆汁酸转化为免疫信号分子至关重要。这就为调节肠道炎症提供了一种潜在的治疗途径,其中肠道炎症可导致诸如炎症性肠病(IBD)之类的自身免疫性疾病产生。
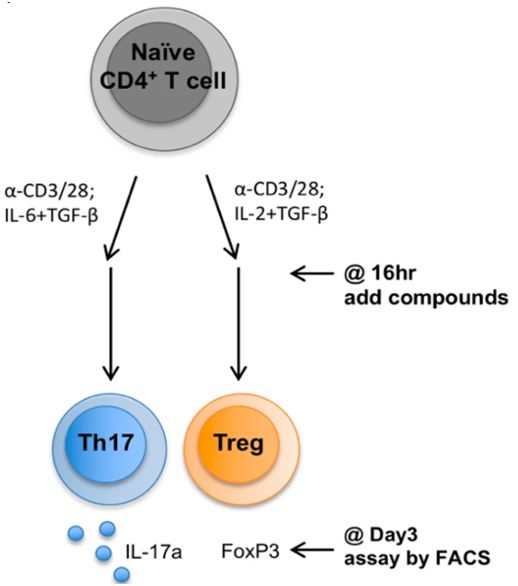
在第一项研究中,哈佛医学院免疫学家Jun Huh及其团队揭示出胆汁酸通过与肠道中的免疫细胞相互作用来发挥它们的免疫调节作用。一旦胆汁酸离开胆囊并完成它们的脂肪溶解作用,它们就会通过消化道,在那里肠道细菌将它们修饰成免疫调节分子。这些经过修饰的胆汁酸随后激活两类免疫细胞:调节性T细胞(Treg)和效应辅助性T细胞(特别是Th17),这两类免疫细胞各自通过抑制或促进炎症来调节免疫反应。相关研究结果近期发表在Nature期刊上,论文标题为“Bile acid metabolites control TH17 and Treg cell differentiation”。
在实验中,Huh团队使用了未分化的小鼠T细胞(即初始小鼠T细胞),并且一次性让它们暴露于多种胆汁酸代谢产物中。这些实验表明两种不同的胆汁酸代谢产物对T细胞产生不同的作用---一种代谢产物促进Treg细胞分化,而另一种代谢产物抑制Th17细胞分化。当Huh团队将这两种胆汁酸代谢产物中的每种施用于小鼠时,他们观察到它们的Th17和Treg细胞相应地下降和上升。此外,他们还发现人类粪便(包括IBD患者的粪便)中也存在这两种胆汁酸副产物。
在第二项研究中,哈佛医学院布拉瓦尼克研究所免疫学教授Dennis Kasper及其研究团队着重研究了由于暴露于肠道微生物而结肠中产生的一个抑制炎症的Treg细胞亚群(称为结肠Treg细胞)。相反而言,大多数其他的免疫细胞起源于胸腺。相关研究结果近期发表在Nature期刊上,论文标题为“Microbial bile acid metabolites modulate gut RORγ+ regulatory T cell homeostasis”。
Kasper的实验表明肠道微生物和饮食可以协同作用来修饰胆汁酸,进而影响小鼠中的结肠Treg细胞水平。他们还发现由于缺乏胆汁酸或胆汁酸传感蛋白而诱导的结肠Treg细胞水平低下,使得小鼠容易患上炎症性结肠炎(inflammatory colitis),即一种类似于人IBD的疾病。
2.PNAS:惨遭胆汁背叛!揭示胆汁酸和神经酰胺促进诺如病毒入侵人小肠细胞机制
doi:10.1073/pnas.1910138117
诺如病毒(norovirus)是导致全球食源性疾病和急性腹泻的主要病毒性病原体。在一项新的研究中,来自美国贝勒医学院等研究机构的研究人员发现这种病毒通过借用一种称为内吞作用的正常细胞过程来感染小肠细胞,其中细胞利用内吞作用从环境中获取物质。相关研究结果近期发表在PNAS期刊上,论文标题为“Bile acids and ceramide overcome the entry restriction for GII.3 human norovirus replication in human intestinal enteroids”。论文通讯作者为贝勒医学院的Mary Estes教授。
这项研究发现两种存在于胆汁中的化合物---胆汁酸和神经酰胺---是诺如病毒成功感染人小肠实验室模型所必需的。此外,这些研究人员首次报道胆汁酸还可以刺激小肠中的内吞作用。这些发现支持进一步探索通过调节胆汁酸和/或神经酰胺水平来减少诺如病毒感染的可能性。
3.Nat Microbiol:肠道微生物调控诺如病毒感染过程
doi:10.1038/s41564-019-0602-7
最近,由圣路易斯华盛顿大学医学院的科学家领导的一项新研究表明,可以根据诺如病毒在肠道中的位置来抑制或提高诺如病毒感染的严重程度。这项研究于11月25日发表在《Nature Microbiology》杂志上,为诺如病毒感染的可能疗法提出了新的途径。
在基于小鼠研究中,研究人员发现正常的肠道细菌会加剧小肠下部病毒感染的严重性。但同时,正常的肠道细菌会阻断或抑制小肠上部的病毒感染。换句话说,肠道微生物对诺如病毒的感染可能具有完全相反的作用,这取决于在肠道中感染的具体位置。“结果表明,肠道的不同区域对这种类型的感染表现出截然不同的反应。我们的研究表明,我们不能将肠道视为对感染做出统一反应的均匀系统。”
进一步,作者发现这种反应差异是由胆汁酸驱动的,胆汁酸主要以其在消化中的作用而闻名。“胆汁酸在整个肠道内都受到细菌的强烈调节。但是还没有人意识到这些胆汁酸可以引发肠道对肠道病毒的免疫反应。”
在这项新研究中,研究人员表明,小肠上部的胆汁酸(而不是下部的胆汁酸)刺激了免疫系统对感染作出反应。研究人员发现,肠道特定部位的胆汁酸触发了一种称为干扰素III的分子。Baldridge指出,肠道微生物与胆汁酸之间相互作用的复杂性可以解释诺如病毒感染中的某些变异性。有些人患这种病毒病得很重。其他人则完全没有症状。“人们对病毒感染的不同反应方式可能与他们各自的肠道微生物群落有关。”
4.PLoS Genet:胆汁酸与个体的遗传学和微生物肠道群落有关
doi:10.1371/journal.pgen.1008073
在近日发表在《PLOS Genetics》上的一项新研究中,威斯康辛大学麦迪逊分校(University of Wisconsin-Madison)的Federico Rey及其同事在小鼠身上发现了影响不同胆汁酸水平以及肠道中特定微生物种群大小的基因变异。
生活在肠道内的复杂微生物种群,是一个人的个体基因与环境影响(如饮食和药物)之间相互作用的结果,但人们对此知之甚少。将这两者联系在一起的一个因素是胆汁酸,人体产生胆汁酸是为了帮助小肠吸收维生素和脂肪,它鼓励一些细菌的生长,抑制另一些细菌的生长。此外,细菌代谢胆汁酸,产生次生胆汁酸,机体也用次生胆汁酸来消化。为了确定影响胆汁酸水平和肠道微生物群落的基因变异,研究人员对400只基因变异小鼠进行了分析。分析指出,有一种基因编码了回肠胆汁酸转运蛋白,这种蛋白从小肠的最后一段吸收胆汁酸,然后循环回到肝脏。这种转运蛋白的基因变异不仅影响一种名为Turicibacter的细菌的数量,还会改变研究人员在血液中检测到的胆汁代谢物的水平。
本研究揭示了Turicibacter与胆汁酸之间的新型相互作用,并首次利用基因图谱将生活在肠道内的微生物群落与胆汁酸代谢产物的图谱结合起来。作者Federico Rey说:"我们对鉴定宿主基因控制下的微生物功能很感兴趣,未来的研究将整合来自宿主肠道的代谢组学、宏基因组学和转录数据。"
5.三篇文章齐发!科学家开发出非酒精性脂肪肝新疗法!
doi:10.1016/S2468-1253(19)30184-0; doi:10.1016/S2468-1253(19)30094-9; doi:10.1002/hep.30509
刊登在国际杂志The Lancet Gastroenterology & Hepatology和Hepatology上的研究报告中,来自奥地利维也纳医科大学的科学家们阐明了人工合成的胆汁酸联合活性制剂非熊去氧胆酸(nor-urso)在治疗原发性硬化性胆管炎(PSC)上的疗效,原发性硬化性胆管炎是一种迄今为止无法治愈的肝脏疾病。
在一项临床试验中,研究人员发现,nor-urso同样能有效治疗非酒精性脂肪肝;目前有超过四分之一的奥地利人会遭受非酒精性脂肪肝的影响,非酒精性脂肪肝通常是由不良的生活方式、机体过多的脂肪和糖分以及缺乏运动导致的,而且常常与肥胖并行。在50-60岁的人群中,有35%-50%的人群都会患上脂肪肝,脂肪肝是一种无声的疾病,通常仅会在个体偶然间体检时被发现,然而长期的脂肪肝则会严重影响机体健康,并会导致肝硬化和肝癌发生,在所有脂肪肝疾病中,大约10%-30%会被归类为最危险的脂肪肝脂肪性肝炎/NASH,其随后会引发15%-25%的患者患上肝硬化。
研究人员指出,最近我们在多个澳大利亚和德国研究中心研究人员的帮助下完成了nor-urso研究的IIa期临床试验,研究结果表明,当该疗法用于治疗非酒精性脂肪肝时能够表现出积极的治疗效果。而且人工合成的胆汁酸还能够保护肝脏免受炎症影响,从而避免肝脏纤维化的发生,研究人员利用胆汁酸的激素效应作为目标。
Trauner表示,胆汁酸就像类固醇激素一样在体内循环,其能够调节机体多种代谢过程,在脂肪肝疾病中,如果患者出现胆汁酸信号抗性的话,其机体的正常代谢过程或许就不太会发挥合适的功能了,nor-urso能够重新增强胆汁酸的激素效应,这或许就能够帮助改善患者的预后以及生活质量。如今研究人员想要进一步研究来检测nor-urso是否能够有效抑制脂肪肝疾病中患者最常见的死亡原因,即诸如心脏病发作或中风等心血管疾病,从而来有效改善患者的预期寿命,研究者表示,这似乎也是合乎逻辑的,我们对此非常乐观,但目前还未证实这一点。
此外,研究人员还利用胆汁酸开发出了另外两种具有潜力的疗法,其中一种方法能够靶向作用胆汁酸受体FXR(胆汁酸传感器)的激活,该受体主要参与了多个机体代谢过程,比如脂质和葡萄糖代谢的调节以及胆汁酸和合成和循环等。今年研究人员将会公布III期临床试验,即利用奥贝胆酸(obeticholic acid)作为治疗原发性胆管炎(PBC),奥贝胆酸是临床上第一个可用的FXR配体,近期其有望作为治疗PBC的二线疗法,而且还能给脂肪肝/NASH患者带来健康效益。
除了奥贝胆酸外,目前还有其它新型的FXR激活子或配体可用,其并不携带胆汁酸结构(所谓的非类固醇类的FXR配体),且具有良好的耐受性;这些再原发性胆道胆管炎中会产生积极的治疗结果。最后研究者Trauner表示,基于个体化治疗的精神,利用胆汁酸的信号特性和激素效应,这些有前途的选择或能为患者提供个体化治疗的可能性,未来我们将会结合上述情况来帮助治疗患者并改善其生活质量。
6.Cell:揭示高脂肪饮食促进结直肠癌产生机制
doi:10.1016/j.cell.2019.01.036
在一项新的研究中,来自美国沙克生物研究所的研究人员指出高脂肪膳食通过扰乱肠道中的胆汁酸平衡和触发一种潜在地让癌细胞茁壮成长的激素信号来促进结直肠癌生长。这些发现可能解释了需要几十年才能形成的结直肠癌,在一个高脂肪膳食普遍存在的时代,却出现在年轻人身上。相关研究结果发表在2019年2月21日的Cell期刊上,论文标题为“FXR Regulates Intestinal Cancer Stem Cell Proliferation”。
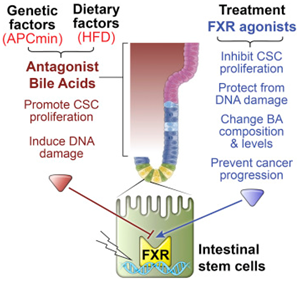
这些研究人员发现给这些小鼠喂食高脂肪膳食就像是火上浇油:高脂肪膳食会增加两种特定胆汁酸的含量,从而抑制法尼酯X受体(Farnesoid X receptor, FXR)的活性。肠道想要自我修复,FXR让这个过程变得缓慢、稳定和安全。当胆汁酸抑制FXR时,一组干细胞开始快速生长和累积DNA损伤。
论文共同作者、沙克生物研究所研究员Annette Atkins说,“我们知道高脂肪膳食和胆汁酸都是癌症的风险因素,但我们并没有期待发现它们都会影响肠道干细胞中的FXR活性。”
接下来,这些研究人员决定测试一种新的抗癌武器。他们使用一种由沙克生物研究所开发的称为FexD的分子,用于激活肠道干细胞中的FXR。FexD似乎抵消了小鼠器官模型和人结肠癌细胞系中不平衡胆汁酸所造成的损伤。虽然在人体测试FexD之前还需要开展更多的实验,但是这些研究人员表示这种候选药物具有一些有希望的特性:它能够到达结肠并且仅作用于FXR,因此它应当产生比其他药物更少的副作用。
7.mSphere:抗生素如何杀灭修饰胆汁酸的细菌进而促进芽孢杆菌的感染
doi:10.1128/mSphere.00045-15
近日,来自北卡罗来纳州立大学等机构的研究人员通过研究发现,可以被大肠中生存的细菌改变的胆汁酸或可抑制艰难梭状芽胞杆菌(C. diff)的生长,这种细菌是一种可以引发机体疼痛甚至死亡的有害细菌,相关研究刊登于国际杂志mSphere上,本文研究为后期科学家们制定新型策略,来避免使用抗生素杀灭改变胆汁酸的微生物进而促进艰难梭状芽胞杆菌引发感染提供了新的希望。
研究者Casey Theriot说道,我们知道在一个健康的肠道环境中,艰难梭状芽胞杆菌的生长会被抑制,但我们想通过研究阐明隐藏在这种抑制效应背后的机制;胆汁酸源自机体脂肪消化和吸收后的胆固醇和酸而产生,胆汁酸可以控制脂蛋白、葡萄糖、药物及机体的能量代谢,初级胆汁酸可以在肝脏中产生,而且通过肠道系统,在大肠中细菌会将这些胆汁酸转化成为次级胆汁酸,而研究者发现大量次级胆汁酸会对艰难梭状芽胞杆菌的生长带来一致性效应。
随后研究者观察了小鼠在多种不同抗生素治疗前后肠道内容物的差别,他们在小鼠治疗前后鉴别出了26种不同的初级胆汁酸和次级胆汁酸,并且确定了他们的浓度,随后研究者将艰难梭状芽胞杆菌的芽孢加入到这些内容物中,目的在于寻找这些细菌如何在现实的肠道环境中萌芽并且生长。更有意思的是,研究人员还发现,小肠中的初级胆汁酸会促进细菌的芽孢萌发,并且开始生长,而这同是否进行抗生素治疗并无关联。
8.Cell Metab:抑制胆汁酸合成和代谢的负反馈机制
doi:10.1016/j.cmet.2015.01.007
近日,来自加州大学洛杉矶分校的研究人员在cell metabolism刊登了他们的一项最新研究成果,他们发现肝脏细胞中FXR激活会诱导MAFG的表达,MAFG进而抑制胆汁酸合成并且改变胆汁酸的组成成分。因此,本文的主要亮点在于发现了胆汁酸合成途径中的一条新的负反馈途径。
胆汁酸是一种强力信号分子,能够调节多种代谢途径影响机体脂质,葡萄糖,胆汁酸平衡以及微生物群构成。胆汁酸是由肝脏中的胆固醇合成的,同时胆汁酸合成过程中的关键酶(cyp7a1,cyp8b1)会受到核激素受体FXR的转录调控。本文研究人员在控制多个胆汁酸代谢基因表达的转录抑制因子MAFG上游发现了一条FXR调节途径并且通过实验证明了MAFG是FXR的目标基因,肝脏中MAFG过表达能够抑制胆汁酸合成基因表达,改变胆汁中胆汁酸构成。除此之外,研究人员利用MAFG+/-小鼠进行功能失活研究发现MAFG基因缺失会解除对胆汁酸合成基因的抑制作用,并引起胆汁中胆汁酸水平的一致变化。最后,他们通过chip-seq分析发现了胆汁酸代谢基因中的功能性MAFG应答元件,证明了FXR调节的MAFG对胆汁酸合成基因的直接调控作用。
综上所述,该文章发现了一个通过FXR调节胆汁酸合成的复杂反馈机制,证明了MAFG能够直接调控胆汁酸合成基因的表达。本文或对研究通过改变胆汁酸合成影响代谢具有一定参考意义。
9.JCI:胆汁酸如何可以抗击糖尿病
doi:10.1172/JCI76289
近日,EPFL科学家已经表明,对于肥胖相关的糖尿病,胆汁酸激活一种受体可以降低脂肪组织炎症和胰岛素抵抗。世界各地肥胖人群日益增多,由于身体不能有效利用胰岛素2型糖尿病患者也有所增加。肥胖的人往往易发生脂肪组织炎症,这反过来又可以降低脂肪细胞对胰岛素的敏感性而导致2型糖尿病。
EPFL科学家表明胆汁酸能够激活一个鲜为人知的受体,此受体能克服胰岛素敏感性的缺失,是开发2型糖尿病新药物的基础。这项工作已经发表在Journal of Clinical Investigation杂志上。
研究小组已经发现,位于巨噬细胞的受体能抑制2型糖尿病的炎症。在这项研究中的巨噬细胞受体被称为TGR5,并且能被胆汁中统称为“胆汁酸”的化学物质所激活。
胆汁酸传统上被认为是仅存在小肠中用以帮助脂质的消化。但是,最近的研究已经表明,胆汁酸也会进入血液,像激素一样作用于受体TGR5,影响不同类型细胞的行为。研究人员发现当TGR5受体被类似于胆汁酸的化合物激活,TGR5引发了细胞分子级联,会减少巨噬细胞的积累,将2型糖尿病相关的炎症最小化。(生物谷 Bioon.com)
促进胆汁酸肠肝循环的动力是肝细胞的转运系统---吸收胆汁酸并将其分泌入胆汁、缩胆囊素诱导的胆囊收缩、小肠的推进蠕动,回肠黏膜的主动运输及血液向门静脉的流入。
目前在动物医学界很多专家对此进行研究,研究发现胆汁酸在动物机体内乳化脂肪扩大与脂肪酶的接触面积;调控胰脂肪酶和脂蛋白酯酶的活性提高其对脂肪的水解代谢;在肠道内转运脂肪,促进脂肪的吸收。另外,胆汁酸通过调控激素敏感脂肪酶的活性,明显减少了自体脂肪的分解代谢。综上所述,胆汁酸能够节约能量原料,提高能量利用率,改善生长性能及屠宰性能,是节约资源的“正能量”。
基于此,小编针对胆汁酸近年来取得的进展进行一番盘点,以飨读者。
1.两篇Nature揭示胆汁酸在调节肠道免疫和肠道炎症中起关键作用
doi:10.1038/s41586-019-1785-z; doi:10.1038/s41586-019-1865-0
胆汁是由肝脏和胆囊产生的汁液。胆汁中的胆汁酸能够溶解脂肪,它们还可能在免疫反应和炎症中起作用吗?根据美国哈佛医学院开展的两项独立的研究,答案似乎是肯定的。这两项以小鼠为实验对象的研究发现胆汁酸可促进几种参与调节炎症并且与肠道炎症性疾病相关的几种类型的T细胞的分化和活性。它们还揭示肠道微生物对于将胆汁酸转化为免疫信号分子至关重要。这就为调节肠道炎症提供了一种潜在的治疗途径,其中肠道炎症可导致诸如炎症性肠病(IBD)之类的自身免疫性疾病产生。

图片来自Nature, 2019, doi:10.1038/s41586-019-1785-z。
在第一项研究中,哈佛医学院免疫学家Jun Huh及其团队揭示出胆汁酸通过与肠道中的免疫细胞相互作用来发挥它们的免疫调节作用。一旦胆汁酸离开胆囊并完成它们的脂肪溶解作用,它们就会通过消化道,在那里肠道细菌将它们修饰成免疫调节分子。这些经过修饰的胆汁酸随后激活两类免疫细胞:调节性T细胞(Treg)和效应辅助性T细胞(特别是Th17),这两类免疫细胞各自通过抑制或促进炎症来调节免疫反应。相关研究结果近期发表在Nature期刊上,论文标题为“Bile acid metabolites control TH17 and Treg cell differentiation”。
在实验中,Huh团队使用了未分化的小鼠T细胞(即初始小鼠T细胞),并且一次性让它们暴露于多种胆汁酸代谢产物中。这些实验表明两种不同的胆汁酸代谢产物对T细胞产生不同的作用---一种代谢产物促进Treg细胞分化,而另一种代谢产物抑制Th17细胞分化。当Huh团队将这两种胆汁酸代谢产物中的每种施用于小鼠时,他们观察到它们的Th17和Treg细胞相应地下降和上升。此外,他们还发现人类粪便(包括IBD患者的粪便)中也存在这两种胆汁酸副产物。
在第二项研究中,哈佛医学院布拉瓦尼克研究所免疫学教授Dennis Kasper及其研究团队着重研究了由于暴露于肠道微生物而结肠中产生的一个抑制炎症的Treg细胞亚群(称为结肠Treg细胞)。相反而言,大多数其他的免疫细胞起源于胸腺。相关研究结果近期发表在Nature期刊上,论文标题为“Microbial bile acid metabolites modulate gut RORγ+ regulatory T cell homeostasis”。
Kasper的实验表明肠道微生物和饮食可以协同作用来修饰胆汁酸,进而影响小鼠中的结肠Treg细胞水平。他们还发现由于缺乏胆汁酸或胆汁酸传感蛋白而诱导的结肠Treg细胞水平低下,使得小鼠容易患上炎症性结肠炎(inflammatory colitis),即一种类似于人IBD的疾病。
2.PNAS:惨遭胆汁背叛!揭示胆汁酸和神经酰胺促进诺如病毒入侵人小肠细胞机制
doi:10.1073/pnas.1910138117
诺如病毒(norovirus)是导致全球食源性疾病和急性腹泻的主要病毒性病原体。在一项新的研究中,来自美国贝勒医学院等研究机构的研究人员发现这种病毒通过借用一种称为内吞作用的正常细胞过程来感染小肠细胞,其中细胞利用内吞作用从环境中获取物质。相关研究结果近期发表在PNAS期刊上,论文标题为“Bile acids and ceramide overcome the entry restriction for GII.3 human norovirus replication in human intestinal enteroids”。论文通讯作者为贝勒医学院的Mary Estes教授。
这项研究发现两种存在于胆汁中的化合物---胆汁酸和神经酰胺---是诺如病毒成功感染人小肠实验室模型所必需的。此外,这些研究人员首次报道胆汁酸还可以刺激小肠中的内吞作用。这些发现支持进一步探索通过调节胆汁酸和/或神经酰胺水平来减少诺如病毒感染的可能性。
3.Nat Microbiol:肠道微生物调控诺如病毒感染过程
doi:10.1038/s41564-019-0602-7
最近,由圣路易斯华盛顿大学医学院的科学家领导的一项新研究表明,可以根据诺如病毒在肠道中的位置来抑制或提高诺如病毒感染的严重程度。这项研究于11月25日发表在《Nature Microbiology》杂志上,为诺如病毒感染的可能疗法提出了新的途径。
在基于小鼠研究中,研究人员发现正常的肠道细菌会加剧小肠下部病毒感染的严重性。但同时,正常的肠道细菌会阻断或抑制小肠上部的病毒感染。换句话说,肠道微生物对诺如病毒的感染可能具有完全相反的作用,这取决于在肠道中感染的具体位置。“结果表明,肠道的不同区域对这种类型的感染表现出截然不同的反应。我们的研究表明,我们不能将肠道视为对感染做出统一反应的均匀系统。”
进一步,作者发现这种反应差异是由胆汁酸驱动的,胆汁酸主要以其在消化中的作用而闻名。“胆汁酸在整个肠道内都受到细菌的强烈调节。但是还没有人意识到这些胆汁酸可以引发肠道对肠道病毒的免疫反应。”
在这项新研究中,研究人员表明,小肠上部的胆汁酸(而不是下部的胆汁酸)刺激了免疫系统对感染作出反应。研究人员发现,肠道特定部位的胆汁酸触发了一种称为干扰素III的分子。Baldridge指出,肠道微生物与胆汁酸之间相互作用的复杂性可以解释诺如病毒感染中的某些变异性。有些人患这种病毒病得很重。其他人则完全没有症状。“人们对病毒感染的不同反应方式可能与他们各自的肠道微生物群落有关。”
4.PLoS Genet:胆汁酸与个体的遗传学和微生物肠道群落有关
doi:10.1371/journal.pgen.1008073
在近日发表在《PLOS Genetics》上的一项新研究中,威斯康辛大学麦迪逊分校(University of Wisconsin-Madison)的Federico Rey及其同事在小鼠身上发现了影响不同胆汁酸水平以及肠道中特定微生物种群大小的基因变异。

图片来源:Kevin Mackenzie, University of Aberdeen, Wellcome Collection, CC BY。
生活在肠道内的复杂微生物种群,是一个人的个体基因与环境影响(如饮食和药物)之间相互作用的结果,但人们对此知之甚少。将这两者联系在一起的一个因素是胆汁酸,人体产生胆汁酸是为了帮助小肠吸收维生素和脂肪,它鼓励一些细菌的生长,抑制另一些细菌的生长。此外,细菌代谢胆汁酸,产生次生胆汁酸,机体也用次生胆汁酸来消化。为了确定影响胆汁酸水平和肠道微生物群落的基因变异,研究人员对400只基因变异小鼠进行了分析。分析指出,有一种基因编码了回肠胆汁酸转运蛋白,这种蛋白从小肠的最后一段吸收胆汁酸,然后循环回到肝脏。这种转运蛋白的基因变异不仅影响一种名为Turicibacter的细菌的数量,还会改变研究人员在血液中检测到的胆汁代谢物的水平。
本研究揭示了Turicibacter与胆汁酸之间的新型相互作用,并首次利用基因图谱将生活在肠道内的微生物群落与胆汁酸代谢产物的图谱结合起来。作者Federico Rey说:"我们对鉴定宿主基因控制下的微生物功能很感兴趣,未来的研究将整合来自宿主肠道的代谢组学、宏基因组学和转录数据。"
5.三篇文章齐发!科学家开发出非酒精性脂肪肝新疗法!
doi:10.1016/S2468-1253(19)30184-0; doi:10.1016/S2468-1253(19)30094-9; doi:10.1002/hep.30509
刊登在国际杂志The Lancet Gastroenterology & Hepatology和Hepatology上的研究报告中,来自奥地利维也纳医科大学的科学家们阐明了人工合成的胆汁酸联合活性制剂非熊去氧胆酸(nor-urso)在治疗原发性硬化性胆管炎(PSC)上的疗效,原发性硬化性胆管炎是一种迄今为止无法治愈的肝脏疾病。
在一项临床试验中,研究人员发现,nor-urso同样能有效治疗非酒精性脂肪肝;目前有超过四分之一的奥地利人会遭受非酒精性脂肪肝的影响,非酒精性脂肪肝通常是由不良的生活方式、机体过多的脂肪和糖分以及缺乏运动导致的,而且常常与肥胖并行。在50-60岁的人群中,有35%-50%的人群都会患上脂肪肝,脂肪肝是一种无声的疾病,通常仅会在个体偶然间体检时被发现,然而长期的脂肪肝则会严重影响机体健康,并会导致肝硬化和肝癌发生,在所有脂肪肝疾病中,大约10%-30%会被归类为最危险的脂肪肝脂肪性肝炎/NASH,其随后会引发15%-25%的患者患上肝硬化。
研究人员指出,最近我们在多个澳大利亚和德国研究中心研究人员的帮助下完成了nor-urso研究的IIa期临床试验,研究结果表明,当该疗法用于治疗非酒精性脂肪肝时能够表现出积极的治疗效果。而且人工合成的胆汁酸还能够保护肝脏免受炎症影响,从而避免肝脏纤维化的发生,研究人员利用胆汁酸的激素效应作为目标。
Trauner表示,胆汁酸就像类固醇激素一样在体内循环,其能够调节机体多种代谢过程,在脂肪肝疾病中,如果患者出现胆汁酸信号抗性的话,其机体的正常代谢过程或许就不太会发挥合适的功能了,nor-urso能够重新增强胆汁酸的激素效应,这或许就能够帮助改善患者的预后以及生活质量。如今研究人员想要进一步研究来检测nor-urso是否能够有效抑制脂肪肝疾病中患者最常见的死亡原因,即诸如心脏病发作或中风等心血管疾病,从而来有效改善患者的预期寿命,研究者表示,这似乎也是合乎逻辑的,我们对此非常乐观,但目前还未证实这一点。
此外,研究人员还利用胆汁酸开发出了另外两种具有潜力的疗法,其中一种方法能够靶向作用胆汁酸受体FXR(胆汁酸传感器)的激活,该受体主要参与了多个机体代谢过程,比如脂质和葡萄糖代谢的调节以及胆汁酸和合成和循环等。今年研究人员将会公布III期临床试验,即利用奥贝胆酸(obeticholic acid)作为治疗原发性胆管炎(PBC),奥贝胆酸是临床上第一个可用的FXR配体,近期其有望作为治疗PBC的二线疗法,而且还能给脂肪肝/NASH患者带来健康效益。
除了奥贝胆酸外,目前还有其它新型的FXR激活子或配体可用,其并不携带胆汁酸结构(所谓的非类固醇类的FXR配体),且具有良好的耐受性;这些再原发性胆道胆管炎中会产生积极的治疗结果。最后研究者Trauner表示,基于个体化治疗的精神,利用胆汁酸的信号特性和激素效应,这些有前途的选择或能为患者提供个体化治疗的可能性,未来我们将会结合上述情况来帮助治疗患者并改善其生活质量。
6.Cell:揭示高脂肪饮食促进结直肠癌产生机制
doi:10.1016/j.cell.2019.01.036
在一项新的研究中,来自美国沙克生物研究所的研究人员指出高脂肪膳食通过扰乱肠道中的胆汁酸平衡和触发一种潜在地让癌细胞茁壮成长的激素信号来促进结直肠癌生长。这些发现可能解释了需要几十年才能形成的结直肠癌,在一个高脂肪膳食普遍存在的时代,却出现在年轻人身上。相关研究结果发表在2019年2月21日的Cell期刊上,论文标题为“FXR Regulates Intestinal Cancer Stem Cell Proliferation”。

图片来自Cell, doi:10.1016/j.cell.2019.01.036。
这些研究人员发现给这些小鼠喂食高脂肪膳食就像是火上浇油:高脂肪膳食会增加两种特定胆汁酸的含量,从而抑制法尼酯X受体(Farnesoid X receptor, FXR)的活性。肠道想要自我修复,FXR让这个过程变得缓慢、稳定和安全。当胆汁酸抑制FXR时,一组干细胞开始快速生长和累积DNA损伤。
论文共同作者、沙克生物研究所研究员Annette Atkins说,“我们知道高脂肪膳食和胆汁酸都是癌症的风险因素,但我们并没有期待发现它们都会影响肠道干细胞中的FXR活性。”
接下来,这些研究人员决定测试一种新的抗癌武器。他们使用一种由沙克生物研究所开发的称为FexD的分子,用于激活肠道干细胞中的FXR。FexD似乎抵消了小鼠器官模型和人结肠癌细胞系中不平衡胆汁酸所造成的损伤。虽然在人体测试FexD之前还需要开展更多的实验,但是这些研究人员表示这种候选药物具有一些有希望的特性:它能够到达结肠并且仅作用于FXR,因此它应当产生比其他药物更少的副作用。
7.mSphere:抗生素如何杀灭修饰胆汁酸的细菌进而促进芽孢杆菌的感染
doi:10.1128/mSphere.00045-15
近日,来自北卡罗来纳州立大学等机构的研究人员通过研究发现,可以被大肠中生存的细菌改变的胆汁酸或可抑制艰难梭状芽胞杆菌(C. diff)的生长,这种细菌是一种可以引发机体疼痛甚至死亡的有害细菌,相关研究刊登于国际杂志mSphere上,本文研究为后期科学家们制定新型策略,来避免使用抗生素杀灭改变胆汁酸的微生物进而促进艰难梭状芽胞杆菌引发感染提供了新的希望。
研究者Casey Theriot说道,我们知道在一个健康的肠道环境中,艰难梭状芽胞杆菌的生长会被抑制,但我们想通过研究阐明隐藏在这种抑制效应背后的机制;胆汁酸源自机体脂肪消化和吸收后的胆固醇和酸而产生,胆汁酸可以控制脂蛋白、葡萄糖、药物及机体的能量代谢,初级胆汁酸可以在肝脏中产生,而且通过肠道系统,在大肠中细菌会将这些胆汁酸转化成为次级胆汁酸,而研究者发现大量次级胆汁酸会对艰难梭状芽胞杆菌的生长带来一致性效应。
随后研究者观察了小鼠在多种不同抗生素治疗前后肠道内容物的差别,他们在小鼠治疗前后鉴别出了26种不同的初级胆汁酸和次级胆汁酸,并且确定了他们的浓度,随后研究者将艰难梭状芽胞杆菌的芽孢加入到这些内容物中,目的在于寻找这些细菌如何在现实的肠道环境中萌芽并且生长。更有意思的是,研究人员还发现,小肠中的初级胆汁酸会促进细菌的芽孢萌发,并且开始生长,而这同是否进行抗生素治疗并无关联。
8.Cell Metab:抑制胆汁酸合成和代谢的负反馈机制
doi:10.1016/j.cmet.2015.01.007
近日,来自加州大学洛杉矶分校的研究人员在cell metabolism刊登了他们的一项最新研究成果,他们发现肝脏细胞中FXR激活会诱导MAFG的表达,MAFG进而抑制胆汁酸合成并且改变胆汁酸的组成成分。因此,本文的主要亮点在于发现了胆汁酸合成途径中的一条新的负反馈途径。
胆汁酸是一种强力信号分子,能够调节多种代谢途径影响机体脂质,葡萄糖,胆汁酸平衡以及微生物群构成。胆汁酸是由肝脏中的胆固醇合成的,同时胆汁酸合成过程中的关键酶(cyp7a1,cyp8b1)会受到核激素受体FXR的转录调控。本文研究人员在控制多个胆汁酸代谢基因表达的转录抑制因子MAFG上游发现了一条FXR调节途径并且通过实验证明了MAFG是FXR的目标基因,肝脏中MAFG过表达能够抑制胆汁酸合成基因表达,改变胆汁中胆汁酸构成。除此之外,研究人员利用MAFG+/-小鼠进行功能失活研究发现MAFG基因缺失会解除对胆汁酸合成基因的抑制作用,并引起胆汁中胆汁酸水平的一致变化。最后,他们通过chip-seq分析发现了胆汁酸代谢基因中的功能性MAFG应答元件,证明了FXR调节的MAFG对胆汁酸合成基因的直接调控作用。
综上所述,该文章发现了一个通过FXR调节胆汁酸合成的复杂反馈机制,证明了MAFG能够直接调控胆汁酸合成基因的表达。本文或对研究通过改变胆汁酸合成影响代谢具有一定参考意义。
9.JCI:胆汁酸如何可以抗击糖尿病
doi:10.1172/JCI76289
近日,EPFL科学家已经表明,对于肥胖相关的糖尿病,胆汁酸激活一种受体可以降低脂肪组织炎症和胰岛素抵抗。世界各地肥胖人群日益增多,由于身体不能有效利用胰岛素2型糖尿病患者也有所增加。肥胖的人往往易发生脂肪组织炎症,这反过来又可以降低脂肪细胞对胰岛素的敏感性而导致2型糖尿病。
EPFL科学家表明胆汁酸能够激活一个鲜为人知的受体,此受体能克服胰岛素敏感性的缺失,是开发2型糖尿病新药物的基础。这项工作已经发表在Journal of Clinical Investigation杂志上。
研究小组已经发现,位于巨噬细胞的受体能抑制2型糖尿病的炎症。在这项研究中的巨噬细胞受体被称为TGR5,并且能被胆汁中统称为“胆汁酸”的化学物质所激活。
胆汁酸传统上被认为是仅存在小肠中用以帮助脂质的消化。但是,最近的研究已经表明,胆汁酸也会进入血液,像激素一样作用于受体TGR5,影响不同类型细胞的行为。研究人员发现当TGR5受体被类似于胆汁酸的化合物激活,TGR5引发了细胞分子级联,会减少巨噬细胞的积累,将2型糖尿病相关的炎症最小化。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


