Cell:揭示前列腺癌骨转移通过产生TGF-β抵抗免疫疗法机制
来源:本站原创 2019-11-20 15:17
2019年11月20日讯/生物谷BIOON/---在一项新的研究中,来自美国德克萨斯大学MD安德森癌症中心的研究人员报道扩散到骨骼的前列腺癌会引发骨组织破坏,进而阻碍T细胞的发育,这就会破坏免疫检查点抑制剂的有效性,毕竟T细胞对治疗的成功至关重要。这一发现揭示了为何免疫疗法在很大程度上不能成功治疗前列腺癌骨转移,并指出可能逆转这种抵抗性的组合治疗。相关研究结果发表在2019年11月14日的Cell
2019年11月20日讯/生物谷BIOON/---在一项新的研究中,来自美国德克萨斯大学MD安德森癌症中心的研究人员报道扩散到骨骼的前列腺癌会引发骨组织破坏,进而阻碍T细胞的发育,这就会破坏免疫检查点抑制剂的有效性,毕竟T细胞对治疗的成功至关重要。这一发现揭示了为何免疫疗法在很大程度上不能成功治疗前列腺癌骨转移,并指出可能逆转这种抵抗性的组合治疗。相关研究结果发表在2019年11月14日的Cell期刊上,论文标题为“Differences in Tumor Microenvironment Dictate T Helper Lineage Polarization and Response to Immune Checkpoint Therapy”。论文通讯作者为德克萨斯大学MD安德森癌症中心生殖泌尿医学肿瘤学教授、免疫学教授Padmanee Sharma博士。
他们的发现还强调了需要以不同的眼光看待转移性癌症。Sharma说,“我们往往认为第4期疾病(stage 4 disease)是统一的,但并非一律如此。我们需要对不同转移部位的免疫微环境进行更多的考虑,以便在我们开发治疗方法时考虑到这些微环境中的不同免疫反应。”
研究指向抗TGF-β和抗CTLA-4的组合使用
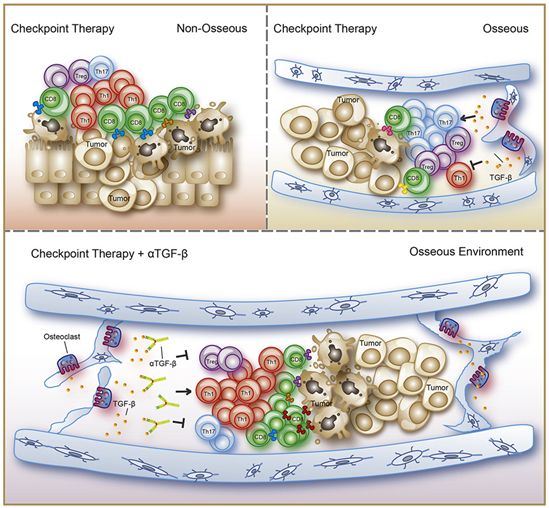
Sharma及其研究团队发现由肿瘤引起的骨骼破坏导致大量产生转化生长因子-β(TGF-β),这种蛋白可导致辅助性T细胞(Th细胞)极化为Th17 CD4细胞,而不是触发抗肿瘤免疫反应所需的Th1 CD4效应细胞。
抗TGF-β治疗与CTLA-4检查点抑制剂联合作用于T细胞可抑制小鼠模型中的骨转移瘤生长。Sharma说:“我们正在努力开发抗CTLA-4和抗TGF-β联合治疗转移性前列腺癌的临床试验。”
大多数男性前列腺癌患者的癌症进展为转移性去势抵抗性疾病,这种转移性疾病几乎都是致命的。患有第4期前列腺癌的男性患者中约70%~80%会发生骨转移。尽管Sharma及其同事们的近期研究已表明,抗CTLA-4免疫检查点抑制剂(ipilimumab, 易普利姆玛)和抗PD-1免疫检查点抑制剂(nivolumab, 纳武单抗)的组合治疗可帮助某些患有4期前列腺癌的男性患者,但是它在阻止骨转移方面基本失败。
为了理解这个问题,Sharma团队首先研究了患者治疗前后的骨髓,以获取有关治疗抵抗性的线索。他们进一步研究了在转移性前列腺癌小鼠模型中的观察结果,并测试了组合治疗。
Th1 CD4 T细胞的缺乏
当起作用时,免疫检查点阻断会导致Th1 CD4效应细胞增殖,而这接着导致杀伤性CD8 T细胞的活化和长期记忆细胞的产生。
Sharma团队在使用易普利姆玛治疗的患者的软组织中发现了大量Th1效应细胞,但这些至为重要的细胞在骨骼中基本上不存在,相反,在那里,他们发现了大量Th17细胞。
Sharma指出:“重要的是骨骼中没有Th1细胞。”细胞因子将辅助性T细胞极化为不同类型,在骨骼微环境中它们会产生大量Th17细胞。Th17细胞的功能尚不清楚。
Sharma团队构建出两种转移性疾病小鼠模型---一种代表骨转移,另一种代表原发性前列腺癌或软组织转移的皮下模型。与在人类患者中一样,使用易普利姆玛和纳武单抗联合治疗可缩小肿瘤并延长患有软组织转移的小鼠的存活期,但对原发性前列腺和骨转移瘤小鼠模型的存活率影响很小。
治疗使得软组织和骨骼中的肿瘤浸润性CD4和CD8 T细胞发生增殖,但未能抑制骨转移瘤的生长。 对这些T细胞进行质谱流式细胞技术(Mass cytometry)分析揭示了其中的原因。骨转移瘤中存在的CD4 T细胞仅属于Th17和调节性T细胞(Treg细胞)谱系,但是骨转移瘤中不存在Th1效应细胞。Treg细胞抑制免疫反应。
在皮下模型中,在治疗前检测到Th1效应细胞,然后在治疗后显著增加,而Th17细胞和Treg细胞在下降。
TGF-β保护骨转移瘤
骨髓中Th1细胞的缺乏表明骨微环境中的细胞因子谱不同。Sharma团队分析了小鼠的荷瘤股骨和无肿瘤股骨中13种细胞因子的水平。他们发现TGF-β的显著升高可以抑制Th1细胞谱系并促进Th17细胞和Treg细胞的产生。Th17细胞还需要IL-6的存在,正如预期的那样,IL-6在骨髓中的含量很高。
骨转移触发了异常的骨骼重塑,并且骨成分被称为TGF-β的主要储存库。Sharma团队猜测骨基质重塑导致前列腺骨转移中的较高TGF-β水平。他们的实验证实,被肿瘤激活的破骨细胞在侵蚀骨骼表面的同时释放出过量的TGF-β。
为了在人体中测试这种猜测,他们比较了健康供者和有或没有骨转移的前列腺癌患者的骨髓中的TGF-β水平。健康对照者和没有骨转移的患者之间的TGF-β水平没有差异,而发生骨转移的患者的骨骼中TGF-β异常高。
阻断TGF-β可恢复Th1细胞并增强免疫疗法
易普利姆玛和纳武单抗的组合治疗未能阻止发生骨转移的小鼠肿瘤生长,但是往这种组合治疗中添加抗TGF-β可以阻止肿瘤生长。
抗TGF-β和易普利姆玛的组合治疗也抑制了骨转移瘤生长。在骨微环境中,这种组合还增加了Th1细胞的频率,并降低了Treg细胞。(生物谷 Bioon.com)
参考资料:
1.Shiping Jiao et al. Differences in Tumor Microenvironment Dictate T Helper Lineage Polarization and Response to Immune Checkpoint Therapy. Cell, 2019, doi:10.1016/j.cell.2019.10.029.
2.Prostate cancer bone metastases thwart immunotherapy by producing TGF-beta
https://medicalxpress.com/news/2019-11-prostate-cancer-bone-metastases-thwart.html

图片来自Cell, 2019, doi:10.1016/j.cell.2019.10.029。
他们的发现还强调了需要以不同的眼光看待转移性癌症。Sharma说,“我们往往认为第4期疾病(stage 4 disease)是统一的,但并非一律如此。我们需要对不同转移部位的免疫微环境进行更多的考虑,以便在我们开发治疗方法时考虑到这些微环境中的不同免疫反应。”
研究指向抗TGF-β和抗CTLA-4的组合使用
Sharma及其研究团队发现由肿瘤引起的骨骼破坏导致大量产生转化生长因子-β(TGF-β),这种蛋白可导致辅助性T细胞(Th细胞)极化为Th17 CD4细胞,而不是触发抗肿瘤免疫反应所需的Th1 CD4效应细胞。
抗TGF-β治疗与CTLA-4检查点抑制剂联合作用于T细胞可抑制小鼠模型中的骨转移瘤生长。Sharma说:“我们正在努力开发抗CTLA-4和抗TGF-β联合治疗转移性前列腺癌的临床试验。”
大多数男性前列腺癌患者的癌症进展为转移性去势抵抗性疾病,这种转移性疾病几乎都是致命的。患有第4期前列腺癌的男性患者中约70%~80%会发生骨转移。尽管Sharma及其同事们的近期研究已表明,抗CTLA-4免疫检查点抑制剂(ipilimumab, 易普利姆玛)和抗PD-1免疫检查点抑制剂(nivolumab, 纳武单抗)的组合治疗可帮助某些患有4期前列腺癌的男性患者,但是它在阻止骨转移方面基本失败。
为了理解这个问题,Sharma团队首先研究了患者治疗前后的骨髓,以获取有关治疗抵抗性的线索。他们进一步研究了在转移性前列腺癌小鼠模型中的观察结果,并测试了组合治疗。
Th1 CD4 T细胞的缺乏
当起作用时,免疫检查点阻断会导致Th1 CD4效应细胞增殖,而这接着导致杀伤性CD8 T细胞的活化和长期记忆细胞的产生。
Sharma团队在使用易普利姆玛治疗的患者的软组织中发现了大量Th1效应细胞,但这些至为重要的细胞在骨骼中基本上不存在,相反,在那里,他们发现了大量Th17细胞。
Sharma指出:“重要的是骨骼中没有Th1细胞。”细胞因子将辅助性T细胞极化为不同类型,在骨骼微环境中它们会产生大量Th17细胞。Th17细胞的功能尚不清楚。
Sharma团队构建出两种转移性疾病小鼠模型---一种代表骨转移,另一种代表原发性前列腺癌或软组织转移的皮下模型。与在人类患者中一样,使用易普利姆玛和纳武单抗联合治疗可缩小肿瘤并延长患有软组织转移的小鼠的存活期,但对原发性前列腺和骨转移瘤小鼠模型的存活率影响很小。
治疗使得软组织和骨骼中的肿瘤浸润性CD4和CD8 T细胞发生增殖,但未能抑制骨转移瘤的生长。 对这些T细胞进行质谱流式细胞技术(Mass cytometry)分析揭示了其中的原因。骨转移瘤中存在的CD4 T细胞仅属于Th17和调节性T细胞(Treg细胞)谱系,但是骨转移瘤中不存在Th1效应细胞。Treg细胞抑制免疫反应。
在皮下模型中,在治疗前检测到Th1效应细胞,然后在治疗后显著增加,而Th17细胞和Treg细胞在下降。
TGF-β保护骨转移瘤
骨髓中Th1细胞的缺乏表明骨微环境中的细胞因子谱不同。Sharma团队分析了小鼠的荷瘤股骨和无肿瘤股骨中13种细胞因子的水平。他们发现TGF-β的显著升高可以抑制Th1细胞谱系并促进Th17细胞和Treg细胞的产生。Th17细胞还需要IL-6的存在,正如预期的那样,IL-6在骨髓中的含量很高。
骨转移触发了异常的骨骼重塑,并且骨成分被称为TGF-β的主要储存库。Sharma团队猜测骨基质重塑导致前列腺骨转移中的较高TGF-β水平。他们的实验证实,被肿瘤激活的破骨细胞在侵蚀骨骼表面的同时释放出过量的TGF-β。
为了在人体中测试这种猜测,他们比较了健康供者和有或没有骨转移的前列腺癌患者的骨髓中的TGF-β水平。健康对照者和没有骨转移的患者之间的TGF-β水平没有差异,而发生骨转移的患者的骨骼中TGF-β异常高。
阻断TGF-β可恢复Th1细胞并增强免疫疗法
易普利姆玛和纳武单抗的组合治疗未能阻止发生骨转移的小鼠肿瘤生长,但是往这种组合治疗中添加抗TGF-β可以阻止肿瘤生长。
抗TGF-β和易普利姆玛的组合治疗也抑制了骨转移瘤生长。在骨微环境中,这种组合还增加了Th1细胞的频率,并降低了Treg细胞。(生物谷 Bioon.com)
参考资料:
1.Shiping Jiao et al. Differences in Tumor Microenvironment Dictate T Helper Lineage Polarization and Response to Immune Checkpoint Therapy. Cell, 2019, doi:10.1016/j.cell.2019.10.029.
2.Prostate cancer bone metastases thwart immunotherapy by producing TGF-beta
https://medicalxpress.com/news/2019-11-prostate-cancer-bone-metastases-thwart.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


