Science子刊:揭示源自肿瘤的TGF-β抑制人CD4+T细胞抗肿瘤免疫反应机制
来源:本站原创 2019-09-22 06:36
2019年9月22日讯/生物谷BIOON/---肿瘤中的转化生长因子β(TGF-β)产生与肿瘤转移和患者预后不良有关。这与TGF-β的促肿瘤作用和免疫抑制作用有关。然而,TGF-β的肿瘤抑制活性也已有报道。因此,尽管TGF-β是一种有希望的癌症治疗靶标,但是如果想要充分利用它的潜力,那么需要对它的细胞效应进行确切的了解。在一项新的研究中,来自瑞士巴塞尔大学的研究人员研究参与TGF-β介导的对一种重
2019年9月22日讯/生物谷BIOON/---肿瘤中的转化生长因子β(TGF-β)产生与肿瘤转移和患者预后不良有关。这与TGF-β的促肿瘤作用和免疫抑制作用有关。然而,TGF-β的肿瘤抑制活性也已有报道。因此,尽管TGF-β是一种有希望的癌症治疗靶标,但是如果想要充分利用它的潜力,那么需要对它的细胞效应进行确切的了解。
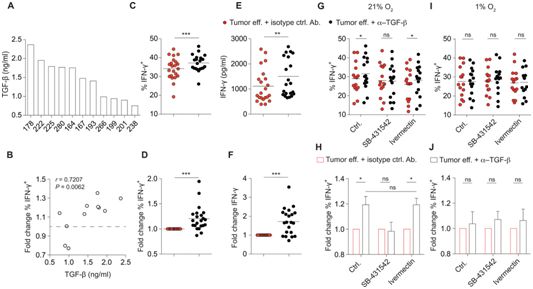
在一项新的研究中,来自瑞士巴塞尔大学的研究人员研究参与TGF-β介导的对一种重要的CD4+ T细胞抗肿瘤功能---γ干扰素(IFN-γ)产生---进行抑制的细胞机制。他们发现来自转移性人类肿瘤的积液以一种依赖TGF-β的方式破坏了IFN-γ的产生,而且以在离体组织中观察到的浓度使用的TGF-β抑制了人类肿瘤相关T细胞中的IFN-γ产生。这种免疫抑制是通过一种需要蛋白Smad磷酸化而不是Smad核转运的机制发生的。TGF-β的抑制作用取决于环境中的氧气丰度。相关研究结果发表在2019年9月17日的Science Signaling期刊上,论文标题为“Tumor-derived TGF-β inhibits mitochondrial respiration to suppress IFN-γ production by human CD4+ T cells”。
这些研究人员确定Smad蛋白存在于不论是在体外还是在体内暴露于TGF-β的T细胞中的线粒体内并发生磷酸化,并且TGF-β在统计学上显著地破坏复合物V的活性和ATP偶联性呼吸作用,其中后者依赖于Smad2。此外,抑制复合物V本身足以破坏CD4+ T细胞中的IFN-γ产生。 TGF-β信号转导在有机体和细胞水平上影响代谢。在肥胖和衰老中,下丘脑TGF-β丰度的增加与全身性葡萄糖耐受不良有关。缺乏Smad3或经TGF-β中和抗体处理的小鼠免受饮食引起的肥胖和糖尿病,这与白色脂肪细胞“褐变”、线粒体生物发生增加以及这些细胞的呼吸能力增强有关。
这些研究人员发现,在用TGF-β处理5或24小时后,协调线粒体生物发生的一组转录因子并未受到转录调控。然而,在存在TGF-β的情况下激活总CD4+ T细胞72小时(以促进Treg细胞的生成),增加了线粒体呼吸能力和脂肪酸氧化(FAO),这与先前的报道相一致,这提示着TGF-β对CD4+ T细胞存在持续时间依赖性的影响。
在细胞水平上,TGF-β可在心肌细胞、肝细胞和T细胞的线粒体中检测到。缺乏TGF-β的T细胞具有异常的线粒体形态,这表明TGF-β在线粒体的生物发生、动力学或这两者中均可能具有稳态作用。迄今为止,尚未评估TGF-β的细胞内在作用与自分泌信号依赖性作用。从功能上讲,TGF-β降低人成纤维细胞的线粒体膜电位(ΔΨm)、小鼠肺上皮细胞的ETC复合物IV的活性和小鼠肾足细胞的复合物IV的功能。TGF-β还通过影响mTORC1活性来抑制细胞代谢。
这些研究人员证实TGF-β抑制了人CD4+ T细胞中的mTORC1,此外,mTORC1直接失活在统计学上显著抑制了CD4+ T细胞中的呼吸作用。不过,他们还发现通过将TGF-β处理与直接的mTORC1抑制作用相结合,TGF-β对CD4+ T细胞的线粒体呼吸具有实质性影响,而与mTORC1调控无关。TGF-β还会破坏肾小动脉细胞线粒体对钙离子的吸收。鉴于钙离子流量对于T细胞信号转导至关重要,因此这种观察结果特别有意义。
根据Smad信号蛋白的结构进行预测,这些蛋白定位于线粒体中;Smad3、Smad4和Smad5在各种细胞类型的线粒体中检测到,但并未在免疫细胞的线粒体中检测到。这项研究如今将复合物V相关的Smad、TGF-β驱动的磷酸化与线粒体抑制和免疫功能受损相关联在一起。
T细胞活化通过生物能机制和非生物能机制驱动细胞代谢发生重要变化,这些变化对它们的效应功能至关重要。在T细胞活化过程中驱动代谢重编程的信号通路已得到很好的描述,它们涉及PI3K-Akt-mTOR轴,以及转录因子c-Myc,雌激素相关受体α(ERR-α)和AP4。来自抑制性受体(比如CTLA-4和PD-1)的信号拮抗这些通路,从而限制了代谢重编程。T细胞效应功能在肿瘤微环境中也因代谢前体分子存在竞争而受到限制。
迄今为止,尚未描述直接调节T细胞代谢以介导免疫调节作用的细胞外源信号。对TGF-β而言,这样的作用与它的免疫调节功能和它在恶性转化的组织部位中大量存在相一致。在维持转录活性和假定的抗肿瘤活性的同时,选择性减轻TGF-β诱导的T细胞代谢性瘫痪可能经证实是一种有效的癌症治疗策略。(生物谷 Bioon.com)
参考资料:
Sarah Dimeloe et al. Tumor-derived TGF-β inhibits mitochondrial respiration to suppress IFN-γ production by human CD4+ T cells. Science Signaling, 2019, doi:10.1126/scisignal.aav3334.
在一项新的研究中,来自瑞士巴塞尔大学的研究人员研究参与TGF-β介导的对一种重要的CD4+ T细胞抗肿瘤功能---γ干扰素(IFN-γ)产生---进行抑制的细胞机制。他们发现来自转移性人类肿瘤的积液以一种依赖TGF-β的方式破坏了IFN-γ的产生,而且以在离体组织中观察到的浓度使用的TGF-β抑制了人类肿瘤相关T细胞中的IFN-γ产生。这种免疫抑制是通过一种需要蛋白Smad磷酸化而不是Smad核转运的机制发生的。TGF-β的抑制作用取决于环境中的氧气丰度。相关研究结果发表在2019年9月17日的Science Signaling期刊上,论文标题为“Tumor-derived TGF-β inhibits mitochondrial respiration to suppress IFN-γ production by human CD4+ T cells”。

图片来自Science Signaling, 2019, doi:10.1126/scisignal.aav3334。
这些研究人员确定Smad蛋白存在于不论是在体外还是在体内暴露于TGF-β的T细胞中的线粒体内并发生磷酸化,并且TGF-β在统计学上显著地破坏复合物V的活性和ATP偶联性呼吸作用,其中后者依赖于Smad2。此外,抑制复合物V本身足以破坏CD4+ T细胞中的IFN-γ产生。 TGF-β信号转导在有机体和细胞水平上影响代谢。在肥胖和衰老中,下丘脑TGF-β丰度的增加与全身性葡萄糖耐受不良有关。缺乏Smad3或经TGF-β中和抗体处理的小鼠免受饮食引起的肥胖和糖尿病,这与白色脂肪细胞“褐变”、线粒体生物发生增加以及这些细胞的呼吸能力增强有关。
这些研究人员发现,在用TGF-β处理5或24小时后,协调线粒体生物发生的一组转录因子并未受到转录调控。然而,在存在TGF-β的情况下激活总CD4+ T细胞72小时(以促进Treg细胞的生成),增加了线粒体呼吸能力和脂肪酸氧化(FAO),这与先前的报道相一致,这提示着TGF-β对CD4+ T细胞存在持续时间依赖性的影响。
在细胞水平上,TGF-β可在心肌细胞、肝细胞和T细胞的线粒体中检测到。缺乏TGF-β的T细胞具有异常的线粒体形态,这表明TGF-β在线粒体的生物发生、动力学或这两者中均可能具有稳态作用。迄今为止,尚未评估TGF-β的细胞内在作用与自分泌信号依赖性作用。从功能上讲,TGF-β降低人成纤维细胞的线粒体膜电位(ΔΨm)、小鼠肺上皮细胞的ETC复合物IV的活性和小鼠肾足细胞的复合物IV的功能。TGF-β还通过影响mTORC1活性来抑制细胞代谢。
这些研究人员证实TGF-β抑制了人CD4+ T细胞中的mTORC1,此外,mTORC1直接失活在统计学上显著抑制了CD4+ T细胞中的呼吸作用。不过,他们还发现通过将TGF-β处理与直接的mTORC1抑制作用相结合,TGF-β对CD4+ T细胞的线粒体呼吸具有实质性影响,而与mTORC1调控无关。TGF-β还会破坏肾小动脉细胞线粒体对钙离子的吸收。鉴于钙离子流量对于T细胞信号转导至关重要,因此这种观察结果特别有意义。
根据Smad信号蛋白的结构进行预测,这些蛋白定位于线粒体中;Smad3、Smad4和Smad5在各种细胞类型的线粒体中检测到,但并未在免疫细胞的线粒体中检测到。这项研究如今将复合物V相关的Smad、TGF-β驱动的磷酸化与线粒体抑制和免疫功能受损相关联在一起。
T细胞活化通过生物能机制和非生物能机制驱动细胞代谢发生重要变化,这些变化对它们的效应功能至关重要。在T细胞活化过程中驱动代谢重编程的信号通路已得到很好的描述,它们涉及PI3K-Akt-mTOR轴,以及转录因子c-Myc,雌激素相关受体α(ERR-α)和AP4。来自抑制性受体(比如CTLA-4和PD-1)的信号拮抗这些通路,从而限制了代谢重编程。T细胞效应功能在肿瘤微环境中也因代谢前体分子存在竞争而受到限制。
迄今为止,尚未描述直接调节T细胞代谢以介导免疫调节作用的细胞外源信号。对TGF-β而言,这样的作用与它的免疫调节功能和它在恶性转化的组织部位中大量存在相一致。在维持转录活性和假定的抗肿瘤活性的同时,选择性减轻TGF-β诱导的T细胞代谢性瘫痪可能经证实是一种有效的癌症治疗策略。(生物谷 Bioon.com)
参考资料:
Sarah Dimeloe et al. Tumor-derived TGF-β inhibits mitochondrial respiration to suppress IFN-γ production by human CD4+ T cells. Science Signaling, 2019, doi:10.1126/scisignal.aav3334.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


