埃博拉疫苗重磅消息!默沙东减毒活疫苗V920在美国进入优先审查,明年3月将获批!
来源:本站原创 2019-09-18 11:07
2019年09月18日讯 /生物谷BIOON/ --默沙东(Merck & Co)近日宣布,美国食品和药物管理局(FDA)已受理其疫苗产品V920(rVSV∆G-ZEBOV-GP,减毒活疫苗)的生物制品许可申请(BLA)并授予了优先审查,该疫苗用于扎伊尔型埃博拉病毒(Ebola Zaire)的预防。FDA将在2020年3月14日作出审查决定。2016年7月,FDA还授予了V92

2019年09月18日讯 /生物谷BIOON/ --默沙东(Merck & Co)近日宣布,美国食品和药物管理局(FDA)已受理其疫苗产品V920(rVSV∆G-ZEBOV-GP,减毒活疫苗)的生物制品许可申请(BLA)并授予了优先审查,该疫苗用于扎伊尔型埃博拉病毒(Ebola Zaire)的预防。FDA将在2020年3月14日作出审查决定。2016年7月,FDA还授予了V920突破性药物资格。
2019年3月,欧洲药品管理局(EMA)受理了V920的营销授权申请(MAA)进行审查。除了与FDA和EMA密切合作,默沙东还向世界卫生组织(WHO)提交了获得资格预审的材料,并向非洲疫苗监管论坛(AVAREF)提交了材料。
默沙东研究实验室副总裁Paula Annunziato医学博士表示:“默沙东已与政府合作伙伴和全球卫生界合作,加速研发研究性V920埃博拉疫苗。FDA的优先审查强调了我们与美国政府在开发和许可方面的长期合作关系。我们的首要任务仍然是实现V920的注册和德国制造工厂的监管批准,以便获得许可生产供应,随着时间的推移支持全球公共卫生准备和卫生安全目标。我们期待着在整个审查过程中继续与FDA合作。”
在努力推进监管审查的同时,默沙东仍继续致力于稳步扩大生产V920的试验性剂量,以帮助国际公共卫生官员和政府当局应对持续、不可预测和不断变化的疫情反应,以及在刚果民主共和国和邻国不断变化的需求。自2018年5月以来,默沙东应世界卫生组织(WHO)请求,向WHO捐赠并运送了24.5万多支1.0ml试验性V920疫苗。除了已经交付的剂量外,目前还有19万多个额外的1.0ml试验性剂量可供使用,并准备应WHO的请求运送到疫情暴发地区。
此外,2019年6月,根据与美国卫生和公众服务部、WHO和全球疫苗联盟正在进行的磋商,默沙东开始执行一项更新的补充战略,以增加试验性V920埃博拉疫苗供应。该战略的目标是在未来6至18个月内,以分阶段的方式分发和提供额外的估计65万份1.0ml试验性剂量。总的来说,过去、现在和即将生产的V920的试验性剂量将超过90万份1.0ml。
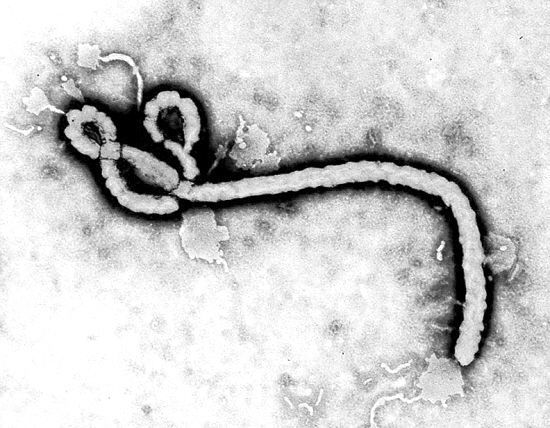
埃博拉病毒(Ebola)是导致埃博拉出血热(EHF)的元凶,该病是一种急性病毒性出血性传染病,症状包括:发烧、头痛、关节和肌肉疼痛、乏力、腹泻、呕吐、胃痛、食欲不振及异常出血。这些症状可在病毒感染后2-21天内出现,但最常见于8-10天。埃博拉病毒不是一种经水传播(water-borne)或食物传播的疾病,也不通过空气传播,该病通过直接接触受感染者体液或已被病毒污染的器具(如针头)传播。
V920采用了一种有缺陷的、能够感染家畜的水泡性口炎病毒,将病毒的一种基因用埃博拉病毒的基因替换。V920最初是由加拿大公共卫生署(PHAC)开发,之后在2010年授权给了NewLink Genetics公司。2014年底,当非洲西部埃博拉疫情达到高峰时,默沙东从NewLink公司签署了一项全球独家授权协议,获得了这款埃博拉疫苗。之后,默沙东一直与一些外部合作者密切合作,在美国政府的部分资助下,开展了一项广泛的临床开发项目,其中包括美国卫生和人类服务部的生物医学高级研究及发展管理局(BARDA)以及美国国防部威胁减少管理局(DTRA)和联合疫苗采办计划(JVAP)等。V920的试验性供给活动由BARDA根据合同号HHSO100201700012C提供部分联邦资金支持。默沙东负责V920的研究、开发、制造及监管工作,该公司已承诺与其他利益相关方密切合作,加速疫苗的持续开发、生产和分销。
图片来自:labiotech.eu
值得一提的是,本月初,FDA授予了Ridgeback Biotherapeutics公司单抗药物mAb114突破性药物资格,这是一种治疗性单抗,起源于1995年刚果民主共和国基奎特市的埃博拉疫情。在那次疫情中,幸存者在感染埃博拉长达十一年后仍保留抗埃博拉抗体,研究人员从这些幸存者体内分离出了抗体,其中mAb114是最有前途的一种。
此次BTD授予,是基于Pamoja Tulinde Maisha(PALM,共同拯救生命)研究的中期数据。该研究测试了4种疗法,包括3种抗体疗法(抗体鸡尾酒ZMapp、三种单抗混合物REGN-EB3[再生元公司]、单克隆抗体mAb114)和一款抗病毒药物remdesvir(吉利德公司),其中ZMapp用作对照。
今年8月公布的来自499例受试者的初步评估结果显示:接受REGN-EB3和mAb114治疗的受试者比其他两组受试者有更大的生存机会。具体数据为:(1)remdesvir、ZMapp、mAb114、REGN-EB3治疗的感染者死亡率分别为53%、49%、34%、29%;(2)在感染后早期治疗且血液病毒水平较低的患者中,数据更强,死亡率分别为:33%、24%、11%、6%。
而目前,整个埃博拉疫情的死亡率为67%。基于上述数据,PALM研究已提前终止,并选择REGN-EB3和mAb114作为扩展期中用于所有未来患者随机治疗的药物,以进一步评估评估安全性直至获得最终临床试验结果。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


