生物谷推荐:5月必看的重磅级研究Top10!
来源:生物谷原创 2022-05-30 14:59
转眼间5月份已经接近尾声了,这个月又有哪些亮点研究值得我们深入学习一下呢?小编根据本月新闻的类型、热度和研究领域筛选出了本月的重磅级研究Top10,与大家一起学习!
转眼间5月份已经接近尾声了,这个月又有哪些亮点研究值得我们深入学习一下呢?小编根据本月新闻的类型、热度和研究领域筛选出了本月的重磅级研究Top10,与大家一起学习!
doi:10.1016/j.cell.2022.04.022
疱疹病毒家族中的病毒是全世界出生缺陷、失明和器官移植失败的主要原因。抗病毒药物可以对抗这些病毒,但是患者往往对这类药物产生抗药性,从而使得它们失去效力。如今,在一项新的研究中,格拉斯通研究所的科学家们开发出一类新的称为反馈干扰剂(feedback disruptors)的药物,它们有可能成为阻止抗药性产生的药物(resistance-proof drug,即防抗药性药物)。相关研究结果于2022年5月12日在线发表在Cell期刊上,论文标题为“Disrupting autorepression circuitry generates 'open-loop lethality' to yield escape-resistant antiviral agents”。
一些对病毒生长至关重要的病毒蛋白在高浓度下会对宿主细胞产生毒性。因此,这些蛋白在水平过高时关闭它们自己的表达,以防止它们所依赖的宿主细胞死亡---这种系统被称为负反馈回路(negative feedback loop)。正如这项新的研究所报道的那样,反馈干扰剂靶向并破坏了这些遗传反馈回路,使受感染的宿主细胞自我毁灭,并阻止感染的发生。
纽约州立大学石溪分校生物医学工程系教授Gábor Balázsi博士(未参与这项新的研究)说,“几十年来,对自然界大量存在的遗传反馈回路进行了分析和表征,但是在此之前如何将这些发现转化为药物仍然是一个挑战。这项新的研究首次表明,反馈回路可以成为治疗病毒感染的药物靶标。这是一个全新的抗病毒治疗概念,可以广泛适用。”
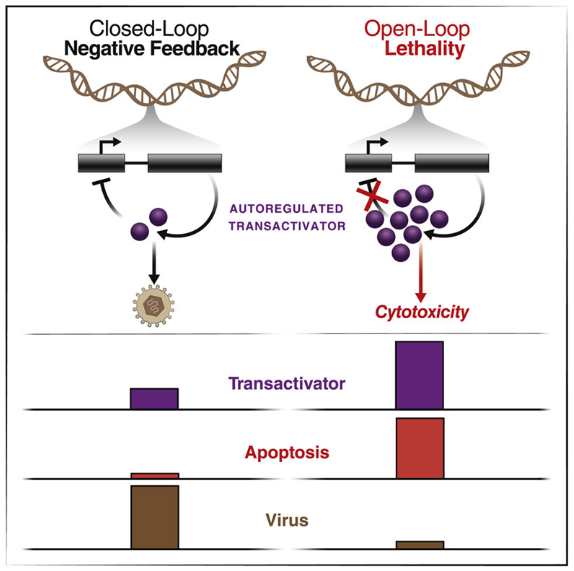
图片来源:Cell, 2022, doi:10.1016/j.cell.2022.04.022。
【2】Nat Commun:特殊的棕榈酰化作用或有望作为开发抗癌药物的新型靶点
doi:10.1038/s41467-022-29685-8
外周膜蛋白能短暂地与细胞膜结合,这是其履行其生物学功能的必要步骤,要想做到这一点,能够催化其脂质修饰的特定酶类就会发挥作用,这一过程称之为棕榈酰化(palmitoylation),其中一些蛋白质能够发生突变并变得具有致癌特性,比如RAS蛋白,其大约是诱发三分之一癌症的主要原因。
近日,一篇发表在国际杂志Nature Communications上题为“Local and substrate-specific S-palmitoylation determines subcellular localization of Gαo”的研究报告中,来自日内瓦大学等机构的科学家们通过研究开发了一种新型工具来能在活细胞中可视化这一过程。
研究者表示,相比他们之前的观点,棕榈酰化作用不仅发生在高尔基体中,其还发生在蛋白质必须发挥作用的位点,比如质膜中等,这一研究发现或许为科学家们开发新型药物策略来精准化靶向作用致癌蛋白的膜结合特性以及活性提供了新的线索和思路。棕榈酰化过程是将脂肪酸引入到特定蛋白质中使其能与细胞膜结合的过程,这一机制是由精确的规则所控制,这主要依赖于每种类型蛋白质的序列以及特定酶类的存在,直到现在,科学界都认为,外周膜蛋白的棕榈酰化只能在细胞中的一个位点发生,即高尔基体中。
【3】JAMA Oncol:肠道微生物组或会改变患者对癌症疗法的反应
doi:10.1001/jamaoncol.2022.0494
自古以来,机体的肠道微生物组就一直是大量细菌、病毒、者均和其它微生物的家园,其被认为会影响人类机体健康的多个方面,最近,测序技术研究显示,肠道微生物组或许在癌症疗法中也发挥着重要作用,近日,一篇发表在国际杂志JAMA Oncology上题为“The Potential of the Gut Microbiome to Reshape the Cancer Therapy Paradigm: A Review”的综述文章中,来自布莱根妇女医院等机构的科学家们通过研究深入揭示了机体肠道微生物组和机体对免疫疗法、化疗和癌症手术等治疗手段所产生的反应之间的关联,相关研究结果或有望帮助开发新方法来靶向作用微生物组从而改善患者的治疗。
研究者Khalid Shah说道,我们都知道,健康的肠道对于机体的整体健康至关重要,我们的肠道之所以如此重要,因为我们经常将其称之为我们的“第二大脑”,近年来,科学家们开始意识到肠道的多方面作用,包括脑肠轴、肠道和机体免疫系统之间的关联,繁殖,肠道功能的紊乱或许就会对机体健康产生负面影响。
这篇研究报告中,研究人员报告了肠道微生物组在免疫疗法中所扮演的一种新角色,免疫检查点抑制剂和免疫检查点阻滞疗法是两种治疗癌症的新型疗法,但对这些形式治疗手段的反应在不同个体之间以及不同的癌症类型之间或许存在很大差异。一些研究发现,在对疗法产生应答的个体和无反应的个体机体的粪便中的细菌种类存在一定的差异,这或许就表明,不同的微生物组组成或许会影响个体的临床反应。而其它研究结果则发现,饮食和益生菌以及抗生素疗法和噬菌体都可以影响机体肠道微生物组的组成,反过来还会影响机体对免疫疗法的反应,尤其是,研究者强调了最近关于生酮饮食对癌症患者所产生影响的相关研究。
【4】Cancer Cell:T细胞的行为或能决定哪些肿瘤会对疗法产生反应
doi:10.1016/j.ccell.2022.04.005
免疫疗法能释放宿主机体免疫系统抵御癌症的力量,然而,对于一些癌症患者而言,免疫疗法似乎并不奏效,近日一篇发表在国际杂志Cancer Cell上题为“An activation to memory differentiation trajectory of tumor-infiltrating lymphocytes informs metastatic melanoma outcomes”的研究报告中,来自美国威尔康乃尔医学院等机构的科学家们通过研究发现,当T淋巴细胞浸润到恶性肿瘤中时,这些T细胞的遗传程序及其随后的发育路径或许就会影响患者对免疫疗法的反应,同时还能帮助预测患者的总体生存率。本文研究结果或许颠覆了科学家们对黑色素瘤患者机体免疫反应的普遍模式,同时还提出了不同的治疗性手段。
这篇研究报告中,研究人员分析了数以千计的人类肿瘤样本以及跨越多种数据集和肿瘤类型的单一人类T细胞,并将其与T细胞对感染、癌症和疫苗(包括人类疫苗)产生反应的许多模型进行比较,结果发现,T细胞要么会卡在早期的激活状态,要么会发展成为能被当前免疫疗法所扩大的记忆细胞。研究者Niroshana Anandasabapathy说道,这些T细胞的行为方式或许并不单一,但我们能理解其行为并以一种能预测患者治疗结局和总体生存率的方式来建立模型。
长期以来,科学家们早就知道,宿主机体的免疫系统能检测并消除肿瘤,但这一过程有时会发生故障,从而导致癌症发生;此前研究数据似乎支持这样一种理论,即一旦肿瘤建立的话,进入肿瘤的T淋巴细胞就会看到并对肿瘤蛋白产生反应,直至其变得筋疲力尽且无法开始攻击癌细胞。这种理论通常能被用来解释称之为免疫检查点阻断过程的疗法的成功,该疗法能利用细胞信号来改善T细胞反应,并能重新唤醒T细胞攻击和消除肿瘤的能力。
图片来源:wikidoc.org
【5】Nature:科学家识别出一种细胞自杀的诱发子 或有望帮助开发治疗皮肤感染的新疗法
doi:10.1038/s41586-022-04717-x
Gasdermins (GSDMs)是一种成孔效应子家族,其能在细胞死亡程序—细胞焦亡中使细胞膜变得通透,GSDMs能通过蛋白水解去除自体抑制性羧基末端结构域而被激活,而这通常是通过caspase调节子来激活的,然而,这个家族的一个成员目前并没有已知的激活子。近日,一篇发表在国际杂志Nature上题为“Group A Streptococcus induces GSDMA-dependent pyroptosis in keratinocytes”的研究报告中,来自埃默里大学等机构的科学家们通过研究发现了皮肤细胞死亡的分子机制,这或许有望帮助开发治疗人类黑色素瘤的新型疗法。
研究者LaRock表示,本文研究揭示了一种在人类机体皮肤中所发现的一种名为gasdermin A的蛋白或能诱导细胞焦亡(一种细胞的死亡形式),正是这种蛋白能通过召唤更多免疫细胞到达指定位点来成为机体对抗细菌感染的早期预警系统。从本质上来讲,我们发现的是,皮肤细胞宁愿自我毁灭也不愿意被危险的细菌所占领。
机体依靠细胞死亡来维持健康,尽管这一过程也会被意外地开启从而造成一定的损伤,然而直到现在,科学家们对这一过程是如何发生的还了解地并不多,本文研究结果或许能推进科学家们对细胞死亡过程的理解,因为其能帮助阐明在皮肤中被诱发激活的原因。研究者指出,诸如A组链球菌这样的细菌被认为是导致皮肤感染的主要病原体,其会引发坏死性筋膜炎或“食肉”疾病,每年有数十万人会因此而死亡或患病,因此临床医生常常需要对患者进行清创和截肢,因为仅靠抗生素的治疗是不可行的。
【6】Science:构建出迄今为止最为庞大的多种人类器官的单细胞图谱
doi:10.1126/science.abl4896
除了极少数例外,我们每个人身体里的数万亿个细胞都携带着基本相同的人类基因组,每个人类基因组包含2万到2.5万个蛋白编码基因。但是,为了执行使生命成为可能的专门功能,像肾脏、肺部、心脏和大脑这样的器官依赖于由独特的细胞类型构建的组织,当每个细胞类型发育到只表达基因组中的特定基因子集时,就会出现这种情况。
在此之前,不同细胞类型的基因表达多样性,即所谓的转录组(transcriptome),一直难以破译。但随着单细胞生物学的迅速发展,科学家们已经开发出一些工具和技术,精确地揭示了构成组织和器官的不同细胞所表达的基因。除了带来对正常生物学的更深理解,这些单细胞方法有望为新的治疗方法开辟途径,因为疾病通常会袭击特定的细胞类型。
在一项新的研究中,来自Tabula Sapiens联盟的研究人员公布了一个巨大的数字图谱,绘制了来自24种人类组织和器官的近50万个细胞的基因表达,包括肺部、皮肤、心脏和血液。相关研究结果发表在2022年5月13日的Science期刊上,论文标题为“The Tabula Sapiens: A multiple-organ, single-cell transcriptomic atlas of humans”。Tabula Sapiens细胞图谱是包括来自同一人类供者的多种组织的最大图谱,也是第一个包括组织的组织学图像的图谱,并纳入了生活在组成肠道不同区室的人类细胞周围的微生物群落的细节。
研究者表示,这些数据的质量和广度是无可比拟的。这个图谱将使科学家们能够提出并回答他们以前从未接触过的有关人类健康和疾病的问题。”
【7】Cell:新研究绘制癌症相关基因突变增强的蛋白-蛋白相互作用图谱
doi:10.1016/j.cell.2022.04.014
在一项新的研究中,来自美国埃默里大学的研究人员揭示致癌突变会导致细胞中的蛋白-蛋白相互作用网络发生广泛扭曲。他们开发出一种类似于地面穿透雷达的过程,因为它能够绘制抗癌药物的潜在前景。相关研究结果于2022年5月4日在线发表在Cell期刊上,论文标题为“Systematic discovery of mutation-directed neo-protein-protein interactions in cancer”。
Fu博士说,“一种突变致癌的原因是蛋白-蛋白相互作用网络发生改变。该突变可能形成一个新的表位:一个新的相互作用表面。这样的单个蛋白残基的改变可以重新连接细胞,引导它走上致癌程序的道路。”
这些作者绘制了由BRAF、AKT1、SPOP和SMAD4等主要癌症相关基因的突变导致的蛋白-蛋白相互作用改变。他们把这些新的突变增强的蛋白-蛋白相互作用称为“新生蛋白-蛋白相互作用(neomorph-protein-protein interaction, neoPPI)”。这项新的研究导致了对癌症中普遍存在的neoPPI的识别,揭示了潜在的肿瘤选择性药物靶标。
在一项病例研究中,这些作者展示了在大多数黑色素瘤以及肺癌和结肠癌中发现的常见基因BRAF突变V600E是如何引发BRAF编码的蛋白和一种氧化还原调节蛋白---KEAP1---之间发生新的相互作用。人们已经对V600E如何扭曲细胞代谢的其他方面进行了研究,但这种相互作用以前并不为人所知。
图片来源:Cell, 2022, doi:10.1016/j.cell.2022.04.024。
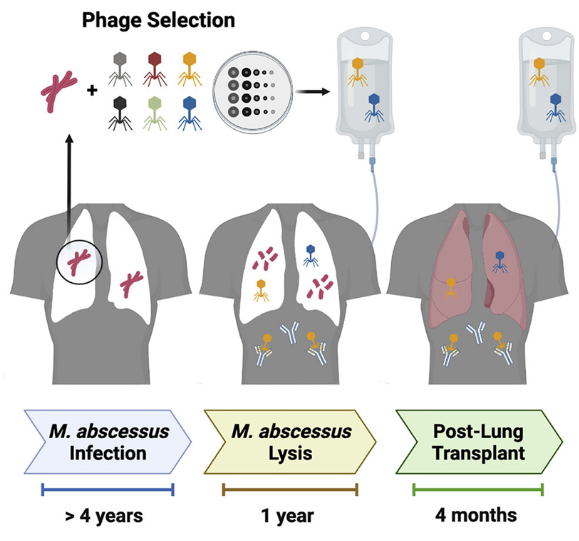
【8】Cell:首次利用噬菌体成功治疗抗生素耐药性分枝杆菌肺部感染
doi:10.1016/j.cell.2022.04.024
在一项新的研究中,来自美国国立犹太医学中心、匹兹堡大学和科罗拉多大学的研究人员首次成功使用噬菌体---杀死细菌的病毒---来治疗抗生素耐药性的分枝杆菌肺部感染,这就为国立犹太医学中心的一名患有囊性纤维化的年轻患者接受挽救生命的肺部移植扫清了道路。这项病例研究报告指出,这些作者成功使用噬菌体来治疗这名患者(即下文的Jarrod Johnson)的脓肿分枝杆菌(Mycobacterium abscessus)肺部感染。相关研究结果于2022年5月13日在线发表在Cell期刊上,论文标题为“Host and pathogen response to bacteriophage engineered against Mycobacterium abscessus lung infection”。
研究者Jerry Nick博士说,“我们多年来一直试图用多种抗生素清除这种分枝杆菌感染,但没有成功。当我们使用这种细菌自身的天敌(即噬菌体)时,我们能够清除这种感染,这导致了成功的肺部移植。”肺部移植受者Jarrod Johnson说,“我非常感谢所有参与我治疗的人的努力、坚持和创造力。我以为我将会死去。他们真地拯救了我的生命。”囊性纤维化是一种遗传性疾病,会导致肺部堆积厚厚的粘液,导致反复的细菌感染,从而损害肺部并可能导致呼吸衰竭。尽管新的治疗方法已经极大地改善了囊性纤维化患者的预后,但这些患者的预期寿命仍然显著降低。
【9】Cell Death & Differ: RUNX2是未来乳腺癌治疗策略的一个有前途的潜在靶点
doi:10.1038/s41418-022-01010-2
乳腺癌是全世界女性中最常见的癌症,也是女性癌症相关死亡的主要原因。在乳腺癌患者中,大约90%的死亡归因于转移。骨转移是最常见的远处转移部位,几乎占转移病例的80%。在转移扩散过程中,来自原发肿瘤的乳腺癌细胞必须首先经历上皮到间质的转变(EMT)以侵入周围组织,进入血液的微血管系统(血管内),最后在骨组织中定居。骨转移是由乳腺癌细胞与成骨细胞和破骨细胞相互作用介导的,涉及异常的骨吸收,促进转移前生态位的形成。Runt相关转录因子2(RUNX2)是一种与成骨相关的转录因子,在肿瘤发生过程中起着重要的转录抑制作用。然而,RUNX2在乳腺癌转移中的作用仍然知之甚少。
近日,来自首都医科大学的研究者们在Cell Death & Differentiation杂志上发表了题为“RUNX2 recruits the NuRD(MTA1)/CRL4B complex to promote breast cancer progression and bone metastasis”的文章,该研究表明,RUNX2是未来乳腺癌治疗策略的一个有前途的潜在靶点。文章中,研究者发现RUNX2招募了转移相关的1(MTA1)/NuRD和Cullin 4B(CUL4B)-Ring E3连接酶(CRL4B)复合体形成转录抑制复合体,催化组蛋白脱乙酰化和泛素化。对RUNX2/NuRd(MTA1)/CRL4B复合靶标的全基因组分析发现了一组基因,包括过氧化物酶体增殖物激活受体α(PPARα)和超氧化物歧化酶2(SOD2),它们在细胞生长、上皮向间充质转化和侵袭过程中起关键作用。
研究者证明RUNX2/NuRD(MTA1)/CRL4B复合体在体外和体内都能促进乳腺癌的增殖、侵袭、肿瘤发生、骨转移和肿瘤干细胞的形成。值得注意的是,RUNX2在包括乳腺癌在内的多种人类癌症中表达上调。
【10】Cell:科学家开发出远程控制的CAR-T细胞,有望更安全更有效地治疗实体瘤
doi:10.1016/j.cell.2022.03.041
在一项新的针对小鼠的研究中,来自斯坦福大学医学院的研究人员发现一种利用患者自身的经过基因修饰的免疫细胞来攻击癌细胞的癌症治疗方法,当可以通过口服药物进行开启和关闭时,会更安全和更有效。相关研究结果发表在2022年5月12日的Cell期刊上,论文标题为“Enhanced safety and efficacy of protease-regulated CAR-T cell receptors”。
这种称为CAR-T细胞疗法的癌症治疗方法对某些类型的血癌有明显的效果。但是,由于一些患者对这些经过基因改造的T细胞(一种免疫细胞)出现了威胁生命的免疫反应,CAR-T疗法通常只在其他治疗方法被尝试过后才使用。它在实体瘤患者中也不太成功,如脑癌和骨癌患者。科学家们认为,这是因为容易发出过度信号的CAR-T细胞在能够消除实肿瘤之前就已经经历功能衰竭。此外,与血癌不同的是,很难在实体瘤上确定只在癌细胞表面上而不是在正常组织中发现的分子靶标。
这些作者设计出一种经过基因修饰的CAR-T细胞疗法---称为SNIP CAR-T,它可用一种已经被美国食品药品管理局(FDA)批准用于人体的抗肝炎口服药物激活。如果没有这种药物,SNIP CAR-T细胞就没有活性。在CAR-T细胞被输注回患者体内后,用药物控制它们的活性能力为那些可能对经过基因改造的T细胞反应不佳的患者提供了一种安全机制。这些作者发现还发现,这些经过基因修饰后的CAR-T细胞在治疗实验室小鼠的实体瘤方面明显更有效---可能是因为当这种日常药物在小鼠体内代谢时,CAR-T细胞经历了短暂、反复的休息期。(生物谷Bioon.com)
更多精彩盘点:
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


