基石药业pralsetinib全球I/II期注册试验完成首例初治RET融合肺癌中国患者给药!
2020年02月14日讯 /生物谷BIOON/ --基石药业(苏州)有限公司(以下简称“基石药业”)近日宣布,由公司合作伙伴Blueprint Medicines开发的在研产品pralsetinib的I/II期注册性试验,已完成首例既往未接受过含铂化疗的RET融合非小细胞肺癌(NSCLC)中国患者给药。该试验是ARROW研究的一部分,旨在评估pralseti
阿斯利康/第一三共抗体药物偶联物Enhertu胃癌注册II期研究成功!
2020年01月28日讯 /生物谷BIOON/ --阿斯利康(AstraZeneca)与合作伙伴第一三共制药(Daiichi Sankyo)近日联合宣布,评估靶向HER2的抗体药物偶联物(ADC)Enhertu(fam-trastuzumab deruxtecan-nxki,DS-8201)治疗HER2阳性转移性胃癌的注册II期试验DESTINY-Gastr
大医精诚,公益为民:2019首届中国医师公益大会在无锡举行
11月2日,2019首届中国医师公益大会在江苏省无锡市隆重举行。本次大会由中国初级卫生保健基金会,北京生命绿洲公益服务中心与人民日报社《民生周刊》联合主办,无锡市卫生健康委,灵山慈善基金会协办,中国红十字基金会,中国器官移植发展基金会,中国癌症基金会,中华社会救助基金会,广东省南山医学发展基金会,中国公益研究院,江苏省红十字会,无锡市红十字会,北京康盟慈善基金会等单位支持。来自国内外的百多家医
吉利德JAK1抑制剂filgotinib注册研究52周数据出炉,将在美申请上市
2019年10月11日讯 /生物谷BIOON/ --美国制药巨头吉利德科学(Gilead Sciences)与合作伙伴Galapagos近日联合宣布,评估口服选择性JAK1抑制剂filgotinib治疗中度至重度活动性类风湿性关节炎(RA)的2项注册III期临床研究FINCH 1和FINCH 3的52周数据与今年早些时候公布的12周和24周分析数据一致并支持了filgotinib的疗效、安全性和耐
礼来RET抑制剂注册性临床试验再获佳绩 年底前递交新药申请
礼来公司(Lilly)在ESMO大会上公布了该公司的RET抑制剂selpercatinib(LOXO-292),在治疗携带RET变异(RETaltered)甲状腺癌患者的临床试验中获得的积极结果。这一结果将支持该公司在年底之前向FDA递交新药申请(NDA)。RET基因变异包括基因融合和激活性点突变,它们可以导致RET信号通路过度激活,细胞生长不受控制。RET基因融合出现在2%的非小细胞肺癌(NSC
上海新政出炉 护士进入区域注册时代
护士也进入区域注册时代了!近日,上海市卫健委印发《上海市护士区域注册管理办法》,为护理人才的多点执业、人才流动释放出政策信号。鼓励二三级医院护士到基层及社会办医执业据了解,出台护士区域注册管理办法的背景,首先是进一步引导护理人才合理流动。充分发挥优质护理资源作用,鼓励二、三级医疗机构护士到基层医疗机构和社会医疗机构执业,提升基层医疗卫生机构在慢病照顾、疾病康复、居家护理等方面的护理服务
我国又一首创口蹄疫标记疫苗通过注册
8月28日,记者从农业农村部第207号公告获悉,由中国农业科学院兰州兽医研究所联合中农威特生物科技股份有限公司等创制的“口蹄疫O型、A型二价3B蛋白表位缺失灭活疫苗(O/rV-1株+ A/rV-2株)”通过了新兽药注册, 这是国际上首例注册的口蹄疫O型、A型二价标记疫苗。2017年10月,“猪口蹄疫O型病毒3A3B表位缺失灭活疫苗(O/rV-1株)”获批一类新兽药注册证书,是当时国际上
基石药业avapritinib晚期GIST I/II期桥接注册试验完成中国首例受试者给药
2019年08月28日讯 /生物谷BIOON/ --基石药业(苏州)有限公司(以下简称“基石药业”)近日宣布,由合作伙伴Blueprint Medicines开发的强效激酶抑制剂avapritinib的I/II期桥接注册性试验实现首例受试者给药。这是一项中国单独的注册桥接研究,包括I期剂量递增和II期剂量扩展试验,目的是评估avapritinib在不可手术切除或转移性胃肠道间质瘤(GIST)患者中
血友病基因疗法获再生医学先进疗法认定 有望启动注册性试验
日前,Sangamo Therapeutics公司和辉瑞公司公布了双方联合开发的A型血友病基因疗法SB-525在1/2期临床试验中获得的最新结果。试验结果表明,SB-525能够剂量依赖性提高凝血因子VIII的水平,并且具有良好的安全性和耐受性。FDA同时授予SB-525再生医学先进疗法(RMAT)认定。基于这些积极结果,两家公司计划将SB-525推入注册性临床试验,辉瑞公司将接手这一疗
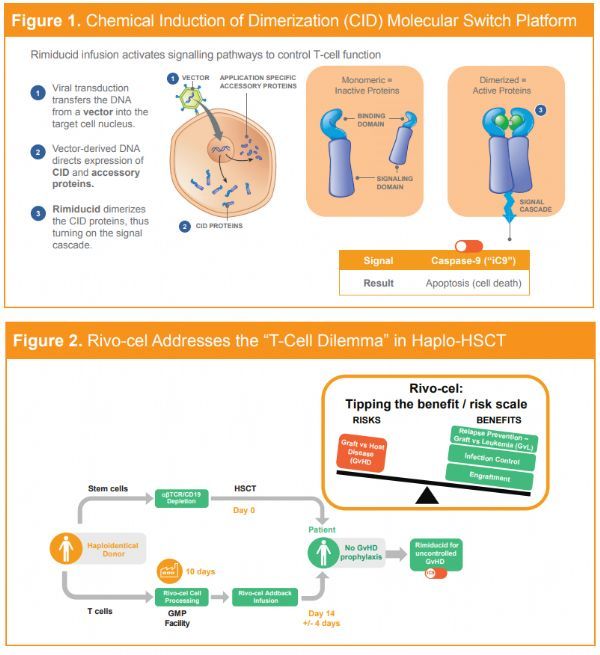
rivo-cel儿科注册研究达主要终点,180天无事件生存率91%!
2019年07月09日/生物谷BIOON/--Bellicum制药公司是开发新型可控细胞免疫疗法治疗癌症和罕见遗传性血液疾病的领导者。近日,该公司宣布异基因多克隆T细胞疗法rivo-cel(rivogenlecleucel,BPX-501)欧盟注册试验BP-004(NCT02065869)达到了180天无事件生存的主要终点。该研究的数据将构成预期提交的rivo-cel与rimiducid营销授权申