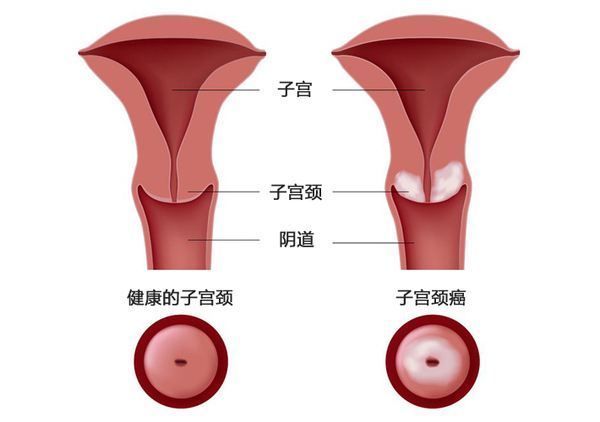
TF靶向抗体药物偶联物(ADC)tisotumab vedotin展现疗效强劲,将申请上市!
总缓解率(ORR)24%、缓解持续时间8.3个月,而标准疗法的ORR通常低于15%。
CD19靶向抗体药物偶联物(ADC)loncastuximab tesirine(Lonca)在美国申请上市!
Lonca治疗弥漫性大B细胞淋巴瘤(DLBCL)的总缓解率达48.3%、完全缓解率24.1%。
雅培个性化实验室整体解决方案GLP 和 Alinity c中国上市 助力医疗绩效管理全面升级
在由中华医学会、中华医学会检验分会举办的中华医学会第十六次全国检验医学学术会议(2020 全国检验医学学术大会)期间,全球领先的医疗健康公司雅培正式发布全新一代实验室自动化系统GLP和全自动生化分析仪Alinity c。雅培诊断业务中国区副总裁陈健忠与山东大学第二医院院长王传新教授和复旦大学附属中山医院潘柏申教授等众多专家共同出席新品上市庆典,深入交流、探讨
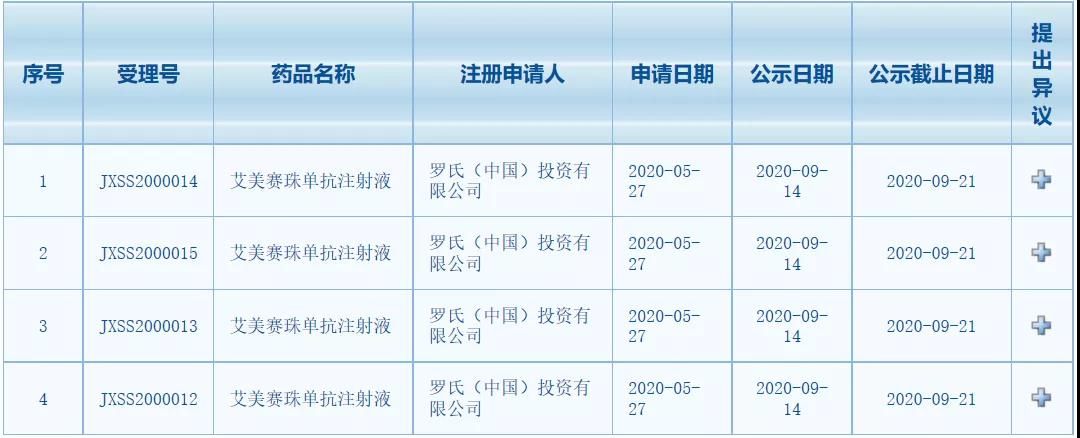
罗氏重磅血友病新药4项上市申请拟纳入优先审评
中国国家药监局药品审评中心(CDE)网站最新公示显示,罗氏(Roche)提交的艾美赛珠单抗注射液(emicizumab,Hemlibra)4项新药上市申请(NDA)拟纳入优先审评。这是一款双特异性抗体,曾被美国FDA授予突破性疗法认定和优先审评资格。在中国,艾美赛珠单抗是临床急需境外新药品种之一,已于2018年通过优先审评审批程序获批上市,治疗A型血友病。根
FDA加速批准Blueprint公司RET抑制剂上市
5日,致力于开发精准疗法的Blueprint Medicines公司宣布,美国FDA加速批准该公司开发的RET抑制剂Gavreto(pralsetinib)上市,用于治疗RET融合阳性非小细胞肺癌(NSCLC)成人患者。此次获批,是基于1/2期临床试验ARROW的数据,该试验显示了Gavreto对初治和经治RET融合阳性NSCLC患者均产生疗效,且无需考虑R
石药集团抗癌药上市申请拟纳入优先审评
今日,中国国家药监局药品审评中心(CDE)网站公示信息显示,石药集团中诺药业递交的“盐酸米托蒽醌脂质体注射液”上市申请拟被纳入优先审评,理由是“符合附条件批准的药品”。该药本次申请的适应症为复发或难治的外周T细胞淋巴瘤(PTCL)患者。盐酸米托蒽醌脂质体是石药集团自主开发的米托蒽醌脂质体制剂,属2.2类改良型新药,石药集团具有完全知识产权。2017年,美国F