盘点:2022年终盘点:2022年Science期刊精华
来源:生物谷原创 2022-12-27 21:32
2022年即将结束,在过去的一年里,Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2022年即将结束,在过去的一年里,Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Science:改写教科书!大肠杆菌的基因表达变化几乎完全发生在细胞生长时的转录阶段
doi:10.1126/science.abk2066
分子生物学的基本原理决定了蛋白是如何在细胞内形成的,这分为两个阶段,即转录和翻译。在转录过程中,储存在DNA中的信息被复制到信使RNA(mRNA)中。随后在翻译过程中,核糖体根据mRNA上的指令,一次一个氨基酸地组装蛋白。对这一过程的理解是如此基础,以至于从DNA到mRNA再到蛋白的信息流动的方向被称为分子生物学的“中心教条”,这是诺贝尔奖得主Francis Crick创造的一个术语。自20年前系统生物学问世以来,科学家们一直试图根据基因表达数据确定细胞如何调节转录和翻译过程:哪些mRNA和蛋白在何种条件下产生的。

调控大肠杆菌基因表达的原则。图片来自Science, 2022, doi:10.1126/science.abk2066。
在一项新的研究中,来自美国加州大学圣地亚哥分校的研究人员首次发现,模式细菌大肠杆菌的基因表达变化几乎完全发生在细胞生长时的转录阶段。他们提供了一个简单的定量公式,将调控控制与mRNA和蛋白水平联系起来。相关研究结果发表在2022年12月9日的Science期刊上,论文标题为“Principles of gene regulation quantitatively connect DNA to RNA and proteins in bacteria”。
论文通讯作者、加州大学圣地亚哥分校物理学与生物科学杰出教授Terry Hwa表示,“最终,我们提供的是一种定量关系,科学家们可以用它来解释致病菌如何逃避抗生素治疗和宿主免疫。在合成生物学的背景下,这将允许对细菌进行重新设计和重新改造,用于检测和清理有毒废物,或被送入体内杀死癌细胞。”
2.Science:合成IL-2回路促进CAR-T细胞浸润免疫抑制性的实体瘤
doi:10.1126/science.aba1624
许多实体瘤对T细胞疗法没有反应,因为它们的免疫抑制性微环境阻止了T细胞的浸润、激活和增殖。主要的肿瘤抑制机制包括抑制T细胞受体(TCR)的信号传导和消耗炎性细胞因子。克服抑制性肿瘤微环境仍然是实体瘤免疫疗法的一个主要障碍。
用炎性细胞因子---比如高剂量的IL-2---补充T细胞的活性,长期以来一直被认为可以驱动有效的抗肿瘤功能。然而,全身性IL-2治疗已被证明具有很强的毒性,会导致严重的不良反应,包括毛细血管渗漏综合征和最终的终末器官功能障碍。细胞自主的细胞因子产生有潜力通过在局部和直接向肿瘤递送细胞因子来克服这些毒性。在一项新的研究中,来自美国加州大学旧金山分校的研究人员设计出携带合成细胞因子回路的治疗性T细胞,在其中,肿瘤特异性synNotch(synthetic Notch)受体驱动IL-2的产生。这种靶向肿瘤的IL-2递送回路提供了一种潜在的方法,可以在局部克服肿瘤抑制,同时将全身性IL-2治疗的毒性降到最低。相关研究结果发表在2022年12月16日的Science期刊上,论文标题为“Synthetic cytokine circuits that drive T cells into immune-excluded tumors”。
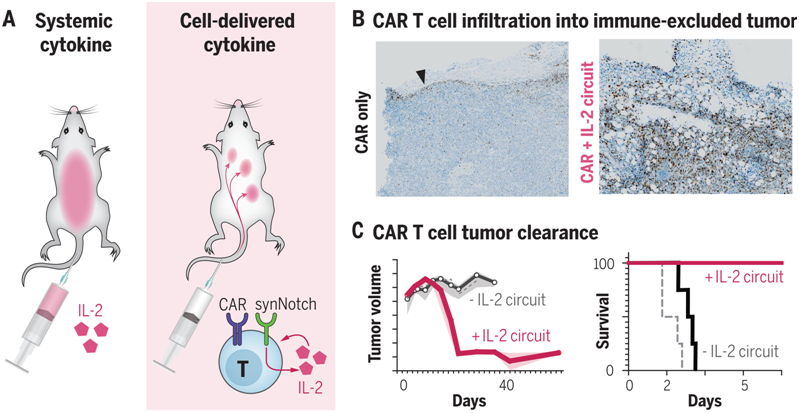
经过基因改造后的治疗性T细胞在肿瘤触发IL-2产生后浸润并清除免疫抑制性的肿瘤。图片来自Science, 2022, doi:10.1126/science.aba1624。
这些作者察到他们设计的synNotch诱导IL-2产生的回路(下称synNotch→IL-2回路)促使嵌合抗原受体(CAR)或TCR T细胞有效地浸润到胰腺癌和黑色素瘤的免疫抑制性肿瘤模型中。在这些具有挑战性的免疫功能的肿瘤模型中,这种浸润的改善与肿瘤清除率和生存率的大幅提高有关。与全身递送IL-2不同,这种局部的IL-2回路不显示毒性,因为它不依赖于TCR/CAR的激活,但仍靶向肿瘤。
然而,用于递送IL-2的确切机制被证明是至关重要的。与经设计后IL-2组成性表达或TCR/CAR诱导的IL-2表达(如来自活化T细胞核因子(NFAT)启动子)的CAR-T细胞相比,携带synNotch→IL-2回路的CAR-T细胞具有更好的抗肿瘤效果。此外,这些作者发现,IL-2的自分泌产生,即同一T细胞表达CAR/TCR和synNotch→IL-2回路,被证明是至关重要的。IL-2的旁分泌递送,即CAR-T细胞受到携带synNotch→IL-2回路的独立T细胞支持,在存在竞争性的内源性IL-2消耗细胞(即消耗IL-2的细胞)---比如宿主调节性T细胞或旁观者T细胞---时,被证明是无效的。
高维免疫分析显示这种IL-2合成细胞因子回路主要作用于T细胞群体,而不会对其他免疫细胞区室造成明显变化。CAR-T细胞和宿主旁观者T细胞对肿瘤的浸润都明显增加。然而,只有抗肿瘤的CAR-T细胞显示出增加的激活、增殖和细胞毒性标志物,以及下降的衰竭标志物。
这些作者猜测这种synNotch→IL-2回路是有效的,因为它绕过了对TCR/CAR激活的要求,并以更强有力的自分泌方式提供IL-2。因此,这些特征使得工程化T细胞能够克服肿瘤免疫抑制的主要模式:抑制TCR信号传递和竞争性细胞因子消耗。这些工程化T细胞似乎充当了先锋,通过它们的由synNotch诱导的IL-2产生在肿瘤中引发增殖,然后协同性地启动CAR/TCR介导的持续性T细胞激活和杀伤。
3.Science:重大进展!发现IFITM蛋白促进细胞高效摄取更大的连接药物分子
doi:10.1126/science.abl5829
在一项新的研究中,来自美国加州大学旧金山分校的Kevan Shokat团队和Luke Gilbert团队发现了一种细胞摄取途径,它对由连接亚基组成的较大药物分子特别重要。这一知识可以被用来构建新的药物,尽管它们很大很复杂以便与它们的靶标进行最佳结合,但却能被靶细胞高效摄取。相关研究结果发表在2022年12月9日的Science期刊上,论文标题为“IFITM proteins assist cellular uptake of diverse linked chemotypes”。
这些作者发现,与对未连接的药物分子的反应相比,实验性连接抗癌药物RapaLink-1对一些基因操纵的反应截然不同,这意味着与传统的小药物分子相比,RapaLink-1依赖于不同的细胞进入和/或药物作用途径。令人鼓舞的是,许多结果相互加强:抑制一个特定的基因可能导致细胞对该药物的抵抗力,而激活同一基因则会促进对该药物的敏感化。

RapaLink-1化学结构式,图片来自Nature, 2022, doi:10.1038/s41586-022-05213-y。
最引人注目的结果是一组三个密切相关的基因,它们似乎能促进RapaLink-1的活性,但对未连接的药物分子没有影响。这些基因编码IFITM蛋白,它们因在抗病毒防御中的作用而闻名,但此前没有证据表明它们会影响药物的作用方式。仅仅通过调节IFITM蛋白的水平,这些作者就能极大地改变RapaLink-的效力约30倍。
这些作者观察了659种不同的细胞类型,发现IFITM的表达水平与对RapaLink-1的敏感性之间有很强的相关性,支持它在不同类型的细胞中发挥普遍作用。通过扩大到17种不同的连接药物分子和未连接的药物分子,他们确定,IFITM基因表达的影响在不同类型的连接药物分子中是一致的。
4.Science:揭示全能性先驱因子Nr5a2激活受精卵基因组机制
doi:10.1126/science.abn7478
精子使卵子受精是新生命的开始。母体和父体的遗传信息,共同储存了有机体的身体构造,在受精后结合在一起。然而,在这个生命的早期阶段,DNA在细胞核中仍处于非活性状态。虽然受精卵细胞的第一次分裂是在储存在卵子中的母体因子的帮助下进行的,但是新的胚胎产物的合成对于胚胎的进一步发育是必要的,这需要接触到胚胎DNA。在一项新的研究中,德国马克斯普朗克生物化学研究所的Kikuë Tachibana和她的研究团队证实全能性先锋因子Nr5a2激活了胚胎DNA。相关研究结果于2022年11月24日在线发表在Science期刊上,论文标题为“Zygotic genome activation by the totipotency pioneer factor Nr5a2”。
论文共同第一作者、马克斯普朗克生物化学研究所显微镜和生物信息学专家Imre Gáspár解释说,“我们为胚胎中产生的早期mRNA分子寻找共同的序列模式,并且能够找到几个序列基序。我们发现的序列基序相互接近,形成了一个所谓的超级基序(supermotif)。这个新发现的超级基序类似于已知的序列基序SINE B1元件,与人类基因组中高度保守的ALU元件有非常密切的关系。这些元件也被称为‘跳跃基因’,因为它们可以在某些细胞阶段(比如早期胚胎)从基因组的一个位置移动到另一个位置。”
Nr5a2结合这个超级基序。论文共同第一作者、马克斯普朗克生物化学研究所胚胎学家Johanna Gassler说,“最初,Nr5a2是在肝脏中发现的。在发育生物学领域,人们知道Nr5a2在胚胎植入的后期阶段很重要。Nr5a2在受精后究竟有多重要还不知道。在我们的实验中,我们能够发现一旦Nr5a2被阻断,大多数早期胚胎mRNA分子就不再产生。此外,胚胎的进一步发育也受到了抑制。这表明,Nr5a2在胚胎发育的最早阶段发挥着核心作用。”
5. Science:发现RNA结合蛋白FMRP让肿瘤逃避免疫系统的识别并对免疫疗法产生抵抗性
doi:10.1126/science.abl7207
在一项新的研究中,来自瑞士洛桑联邦理工学院、伯尔尼大学和洛桑大学医院等研究机构的研究人员发现了一种蛋白在帮助肿瘤逃避免疫破坏方面发挥着关键作用。这种被命名为“脆性X智力迟钝蛋白(fragile X mental retardation protein, FMRP)”的RNA结合蛋白调控着肿瘤微环境中的一个基因和细胞网络,有助于提高它“躲避”免疫细胞的能力。正常情况下,FMRP参与调节蛋白翻译和神经元中mRNA的稳定性。但是他们发现,它在多种类型的癌症中发生异常地上调。相关研究结果发表在2022年11月18日的Science期刊上,论文标题为“Aberrant hyperexpression of the RNA binding protein FMRP in tumors mediates immune evasion”。

FMRP能使肿瘤逃避免疫系统的攻击。图片来自Science, 2022, doi:10.1126/science.abl7207。
在这项新的研究中,这些作者使用了著名的CRISPR-Cas9基因编辑技术,敲除了由小鼠胰腺、结肠、乳腺和皮肤黑色素细胞引起的癌细胞中产生FMRP的基因(名为FMR1)。然后,他们将敲除FMRP的癌细胞与仍有FMR1基因并因此表达FMRP蛋白的癌细胞进行比较。
他们评估了含有FMRP基因敲除癌细胞的小鼠和FMRP阳性野生型癌细胞的小鼠的存活率,首先在免疫系统受到损害的小鼠中进行。他们的比较结果显示这两组小鼠具有类似的存活率。值得注意的是,当他们将基因敲除肿瘤与免疫系统正常运作的小鼠体内生长的野生型肿瘤进行比较时,他们发现没有FMRP的肿瘤生长速度较慢,而它们的存活时间更长。
这部分研究显示的是,FMRP并不参与刺激肿瘤生长本身,而是与适应性免疫系统(我们用疫苗“训练”的那部分免疫系统)有关。
他们的观察结果---野生型肿瘤很少有浸润性T细胞,而FMRP基因敲除肿瘤则高度发炎---进一步证实了这一点。剔除FMRP基因敲除的肿瘤中的T细胞导致它们开始更快速地生长,并降低了小鼠的存活率,这意味着FMRP以某种方式参与了肿瘤对免疫系统的逃避。
6. Science:靶向过度活跃的脑细胞的新型基因疗法有望治疗神经系统疾病
doi:10.1126/science.abq6656
在一项新的研究中,来自英国伦敦大学学院的研究人员开发出一种治疗神经和精神疾病的新方法,该方法通过降低过度活跃的脑细胞的放电而发挥作用。相关研究结果发表在2022年11月4日的Science期刊上,论文标题为“On-demand cell-autonomous gene therapy for brain circuit disorders”。
论文共同通讯作者、伦敦大学学院皇后广场神经学研究所的Gabriele Lignani博士说,“我们发明了一种新的基因疗法,它只在过度活跃的脑细胞中开启而发挥作用,如果它们恢复正常,它就自行关闭。我们利用了某些DNA序列的能力来控制基因表达,以响应代谢信号。通过重新引导这种活跃感应机制来驱动阻止脑细胞放电的分子的产生,我们发现癫痫发作可以得到抑制。”
为了开发这种新的基因疗法,这些作者筛选了几个已知能对刺激作出反应而被激活的基因,并将它们的启动子与因能够减少神经细胞放电而被选中的钾离子通道偶联在一起。这种启动子-钾离子通道的组合使用在小鼠体内和在培养皿里培养的微型大脑样结构(即大脑类器官)中进行了测试,这种大脑类器官是用皮肤衍生的人类干细胞制造的。
他们发现即时早期基因cfos启动子与KCNA1钾离子通道基因的组合使用经证实在诱导癫痫发作后能高度有效地抑制神经元放电,也能抑制自发性癫痫发作,而对认知能力没有任何负面影响。
这种新的治疗方法比以前在同一模型中测试的基因疗法或抗癫痫药物更有效,可使得癫痫小鼠的自发性癫痫发作减少了约80%。这些作者表示,这种新的基因疗法最终在理论上也可能用于治疗其他一些脑细胞过度活跃的疾病,如帕金森病。
7.Science:重大进展!解析丙型肝炎病毒E1E2蛋白复合物的三维结构
doi:10.1126/science.abn9884
在一项新的研究中,来自美国斯克里普斯研究所、荷兰阿姆斯特丹大学和英国南安普敦大学的研究人员在病毒学领域实现了一个重要目标:在高分辨率下绘制了丙型肝炎病毒(HCV)表面上的使得这种病毒能够进入宿主细胞的关键蛋白的结构。这一发现详细说明了这种病毒表面上的关键脆位点,如今可以利用疫苗高效靶向这些位点。相关研究结果发表在2022年10月21日的Science期刊上,论文标题为“Structure of the hepatitis C virus E1E2 glycoprotein complex”。
这些作者发现他们可以组合使用三种广泛中和抗HCV抗体来稳定E1E2复合物的天然构象。广义中和抗体是那些能够防止广泛的病毒毒株的抗体,通过与病毒表面上相对无变化的位点结合来中断病毒生命周期。他们使用低温电子镜对用抗体稳定的E1E2蛋白复合物进行了成像。在先进的图像分析软件的帮助下,他们能够构建出E1E2复合物的结构图,其清晰度和广度是前所未有的---接近原子尺度的分辨率。
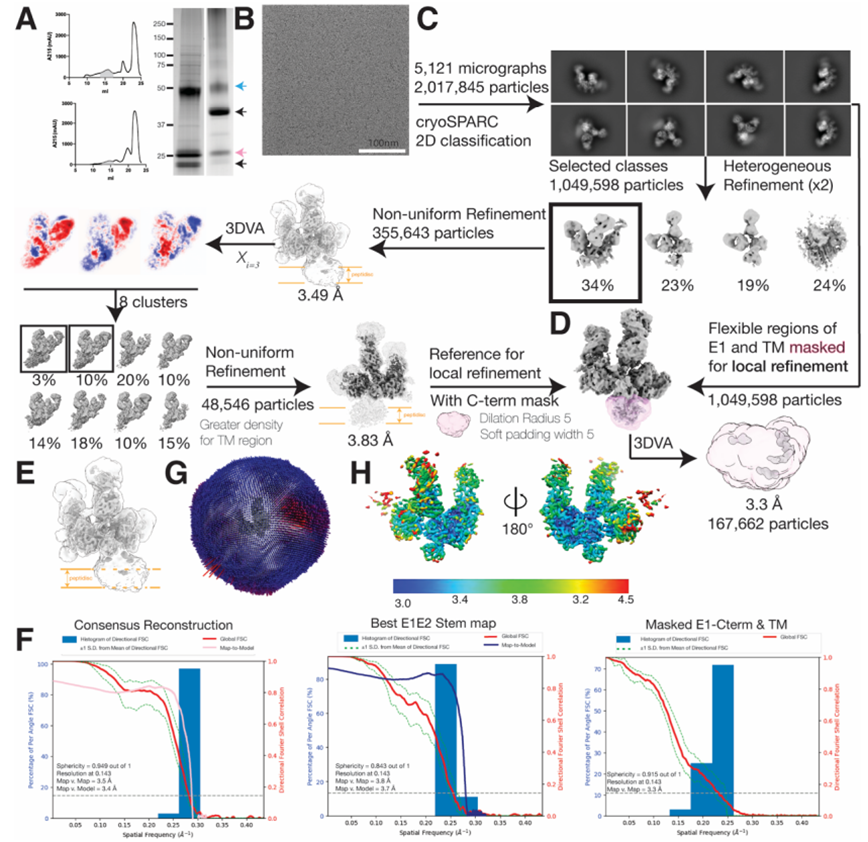
全长HCV包膜糖蛋白E1E2异源二聚体与广泛中和抗体AT1209、IGH505和AR4A结合在一起时的低温电镜处理流程。图片来自Science, 2022, doi:10.1126/science.abn9884。
这种结构图揭示的细节包括大部分的E1和E2蛋白结构,包括关键的E1/E2界面,以及三个抗体结合点。这些结构数据还阐明了位于E1E2顶部的一系列与糖有关的“聚糖”分子。病毒经常使用聚糖来保护自己不受受感染宿主的免疫系统的影响,但在这项新的研究中,这些结构数据显示HCV的聚糖显然有另一个关键作用:帮助将脆弱的E1E2复合物固定在一起。掌握E1E2复合物的这些细节将有助于科学家们合理地设计一种有力地激发广泛中和抗体来阻止HCV感染的疫苗。
8. Science:重大进展!揭示MTCH2是线粒体外膜蛋白插入酶
doi:10.1126/science.add1856
线粒体外膜上的蛋白尤其重要;它们允许线粒体与细胞的其他部分进行交流,并在免疫功能和一种称为细胞凋亡的程序性细胞死亡中发挥作用。在进化的过程中,细胞演化出一种特定的机制,将这些在细胞质中制造的蛋白插入线粒体膜中。但这种机制是什么,以及哪些细胞参与者参与其中,长期以来一直是个谜。
在一项新的研究中,来自美国麻省理工学院怀特黑德研究所和加州理工学院的研究人员为这个谜团提供了一个解决方案。他们揭示一种与许多细胞过程、甚至癌症和阿尔茨海默病等疾病有关的蛋白---MTCH2(mitochondrial carrier homolog 2)---充当各种蛋白进入线粒体外膜的门户,它是线粒体外膜蛋白插入酶。相关研究结果发表在2022年10月21日的Science期刊上,论文标题为“MTCH2 is a mitochondrial outer membrane protein insertase”。
论文共同通讯作者、怀特黑德研究所成员Jonathan Weissman说,“在此之前,没有人知道MTCH2到底在做什么---人们只知道,当失去它时,所有这些不同的事情都会发生在细胞上。为什么这种蛋白会影响这么多不同的过程,这有点像一个谜。这项新的研究为理解为什么MTCH2与阿尔茨海默病、脂质生物合成和线粒体裂变和融合有关提供了分子基础:因为它负责在线粒体外膜上插入所有这些不同类型的蛋白。”
论文共同通讯作者、加州理工学院的Rebecca Voorhees教授说,“我们实验室之间的合作对于理解这种相互作用的生物化学至关重要,并导致了对细胞生物学中一个基本问题的真正令人兴奋的新理解。”
9. Science:挑战常规!衰老细胞并非都是有害的,特定衰老细胞亚群可激活附近的干细胞,促进组织损伤修复
doi:10.1126/science.abf3326
在一项新的研究中,来自美国加州大学旧金山分校的研究人员发现并不是所有的衰老细胞都是有害的应该被消灭以防止年龄相关疾病的“僵尸细胞(zombie cell)”,而且其中的一些衰老细胞嵌入年轻、健康的组织中,并促进损伤的正常修复。相关研究结果发表在2022年10月14日的Science期刊上,论文标题为“Sentinel p16INK4a+ cells in the basement membrane form a reparative niche in the lung”。
这些作者如今观察到一部分衰老细胞在肺部组织以及其他作为身体屏障的器官(比如小肠、结肠和皮肤)中发挥作用。当他们使用称为senolytics(衰老细胞裂解药物)的药物来杀死这些细胞时,肺部组织的损伤愈合得更慢。
为了给他们的研究构建一种更强大的工具,论文第一作者、加州大学旧金山分校博士后学者Nabora Reyes de Barboza博士及其同事们改进了一种常见的技术,将一个相关的基因---在这项新的研究中是在衰老细胞中过度活跃的p16基因---与作为一种标记物在紫外光照射下显示细胞位置的绿色荧光蛋白(GFP)融合在一起。通过增加这些衰老细胞中GFP的数量和稳定性,Reyes极大地放大了它产生的荧光信号,最终使得他们能够在活体组织的天然环境中观察到衰老细胞。
利用这种高度敏感的工具,这些作者发现,衰老细胞存在于年轻和健康的组织中,其程度比以前想象的要大,而且实际上在出生后不久就开始出现了。他们还确定了衰老细胞分泌的用来刺激干细胞生长和修复组织的特定生长因子。与衰老和组织损伤相关的是发现免疫系统中的细胞,比如巨噬细胞和单核细胞,可以激活衰老细胞,这表明在衰老或受损组织中看到的炎症是衰老细胞活动和再生的一个重要调节因素。
在对肺部组织的研究中,Peng及其团队观察到发出绿色荧光的衰老细胞位于基底膜上的干细胞旁边,基底膜是防止外来细胞和有害化学物进入身体的屏障,也允许氧气从肺部空气中扩散到下面的组织。损伤可能发生在这个动态界面。该团队在小肠、结肠和皮肤等其他屏障器官的类似位置中观察到了衰老细胞,而且他们的实验证实,如果用senolytics杀死衰老细胞,肺干细胞就无法正常修复屏障表面。加州大学旧金山分校巴卡老龄化研究所主任、实验病理学教授Leanne Jones博士说,Peng的研究对老龄化研究领域确实意义重大,该领域的目标是帮助人们活得更长久、更健康。
10. Science:重大进展!发现让细胞骨架主要组分肌动蛋白成熟的神秘基因---ACTMAP
doi:10.1126/science.abq5082
荷兰癌症研究所遗传学者Thijn Brummelkamp在被问及为何他擅长追踪其他人没有发现的蛋白和基因时回答说,“我非常善于大海捞针”,尽管有些蛋白和基因在长达40年的时间里仍然难以捉摸。在一项新的研究中,Brummelkamp及其团队再次成功追踪到了这些“神秘基因”中的一个:确保最终形式的肌动蛋白生成的基因。相关研究结果发表在2022年9月30日的Science期刊上,论文标题为“Actin maturation requires the ACTMAP/C19orf54 protease”。

微管蛋白去酪氨酸化是由不同的MATCAP和vasohibin去酪氨酸酶进行的。图片来自Science, 2022, doi:10.1126/science.abn6020。
正如Brummelkamp团队在Science期刊上所描述的那样,在一种蛋白成熟之前并且能够在细胞中完全发挥它的功能之前,它通常必须先被移除一个特定的氨基酸。然后,这个氨基酸被一把分子剪刀从这种蛋白上剪掉。这也是发生在肌动蛋白中的情况。人们知道这个相关的氨基酸--- N末端乙酰化蛋氨酸---是在肌动蛋白的哪一侧被剪掉的。然而,没有人成功找到在这个过程中充当分子剪刀的酶。
Brummelkamp团队的博士后Peter Haahr进行了以下实验:首先他在随机单倍体细胞中引入随机突变(错误)。然后,他通过在这些细胞中添加荧光标记的抗体来选择含有未成熟肌动蛋白的细胞,所添加的抗体正好结合这个氨基酸被移除的位置。作为第三步,也是最后一步,他研究了在这一过程后哪个基因发生突变。
Haahr追踪到了从肌动蛋白上剪除这个必需氨基酸的分子剪刀。这种分子剪刀原来是由一个先前功能未知的没有人之前研究过的基因控制的。这意味着Brummelkamp团队能够自己为这个基因命名,他们命名为ACTMAP(ACTin MAturation Protease,肌动蛋白成熟蛋白酶)。
为了测试ACTMAP的缺乏是否会导致有机体出现问题,他们关闭了小鼠体内的这个基因。他们观察到,这些小鼠的细胞骨架中的肌动蛋白仍未成熟,正如预期的那样。他们惊讶地发现,这些小鼠确实活了下来,但却遭受了肌肉无力。
11. 重大进展!两篇Science论文发现与病毒感染和遗传性代谢疾病相关的关键蛋白---LYSET
doi:10.1126/science.abn5648; doi: 10.1126/science.abn5637
溶酶体是细胞中至关重要的的降解区室。可溶性酶转运溶酶体中依赖于GlcNAc-1磷酸转移酶介导的可溶性酶标记上甘露糖-6-磷酸。GlcNAc-1磷酸转移酶的缺乏导致了严重的溶酶体储存障碍粘脂贮积病II型(MLII)。一些病毒需要溶酶体组织蛋白酶来裂解结构蛋白,因此依赖于功能性GlcNAc-1磷酸转移酶。
在一项新的研究中,来自美国斯坦福大学、德国汉堡大学医学中心和基尔大学等研究机构的研究人员寻找了RNA病毒(比如SARS-CoV-2)复制所必需的的宿主因子。为此,他们在体外培养的人类细胞中进行了全基因组CRISPR/Cas敲除筛选,以探究哪些细胞在感染某些病毒后能够存活下来。相关研究结果于2022年9月8日在线发表在Science期刊上,论文标题为“The human disease gene LYSET is essential for lysosomal enzyme transport and viral infection”。
这些作者在这项新的研究中确定了溶酶体酶转运因子(LYSET)对依赖组织蛋白酶的病毒(包括SARS-CoV-2)的感染至关重要,而在此之前,它的功能是未知的。它对溶酶体的正常运作至关重要,并使人们能够深入了解一种罕见的溶酶体储存障碍的产生。LYSET的缺乏导致M6P标记的全面丧失和GlcNAc-1磷酸转移酶从高尔基体到溶酶体的错误定位。Lyset敲除小鼠表现出类似MLII的表型,而且人类致病的LYSET等位基因未能恢复溶酶体分选缺陷。因此,LYSET是M6P转运机制正确运作所必需的,而LYSET的突变可以解释相关疾病的表型。
与此同时,在第二项新的研究中,来自德国癌症研究中心和奥地利维也纳生物中心的研究人员通过在确定的营养条件下的遗传筛选确定了LYSET的特征。他们发现LYSET在高尔基体中与GlcNAc-1磷酸转移酶结合在一起,后者通过甘露糖-6-磷酸修饰将分解酶靶向到溶酶体中。如果没有LYSET,GlcNAc-1磷酸转移酶因具有一个亲水的跨膜结构域而变得不稳定。因此,LYSET缺乏的细胞缺乏溶酶体酶,并在巨胞饮和自噬货物的周转方面受到损害。相关研究结果于2022年9月8日在线发表在Science期刊上,论文标题为“Lysosomal enzyme trafficking factor LYSET enables nutritional usage of extracellular proteins”。
鉴于哺乳动物细胞可以通过巨胞饮作用(macropinocytosis)和溶酶体对胞外蛋白的分解产生氨基酸,癌细胞利用这一点在营养不良的肿瘤中生长,LYSET代表了溶酶体酶转运途径的一个核心成分,是遗传性溶酶体储存障碍的病理机制的基础,并可能代表一种抑制癌症中代谢适应的靶标。
12. Science:重大进展!首次通过在人体中接种疫苗诱导针对HIV的广泛中和抗体前体分子产生
doi:10.1126/science.add6502
人们通常认为为了使HIV疫苗广泛有效,它必须刺激人体产生能够中和一系列HIV病毒毒株的抗体,即广泛中和抗体(bnAb)。如今科学家们说,他们已经朝着这个方向迈出了重要的一步。
在一项新的初步研究中,来自美国国家过敏与传染病研究所、斯克里普斯研究所、弗雷德-哈金森癌症研究中心和华盛顿大学等研究机构的研究人员发现一种实验性HIV疫苗能够诱导产生针对HIV的bnAb抗体所必需的人体免疫系统反应。这是首次证实一种疫苗能够在人类身上做到这一点。相关研究结果发表在2022年12月2日的Science期刊上,论文标题为“Vaccination induces HIV broadly neutralizing antibody precursors in human”。
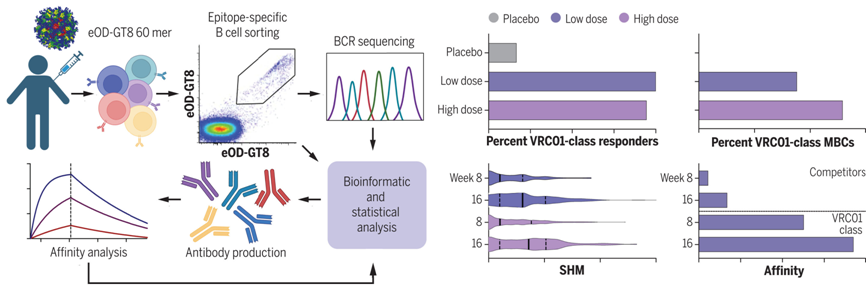
图片来自Science, 2022, doi:10.1126/science.add6502。
这项新的研究以48名健康成年人为研究对象,这些参与者接受了两剂实验性HIV疫苗或者两剂安慰剂(非活性物质)。在36名接种这种实验性HIV疫苗的参与者中,35人显示罕见的产生针对HIV的bnAb抗体前体分子的称为B细胞的免疫细胞大幅增加。这一成就是“概念上的证明”,表明一种疫苗有可能诱发这种反应。
这项新研究测试的一种实验性HIV疫苗被称为eOD-GT8 60mer。它是一种能引起免疫反应的工程化免疫原。它被设计用来刺激和扩大某些罕见的有潜力产生抗击HIV的bnAb抗体的B细胞。
在接受这种实验性HIV疫苗的36名志愿者中,没有任何安全问题。除了一个人之外,所有的人都表现出了这些作者寻找的免疫反应。McElrath和Kelley都说,这是一个必要的步骤。但是这只是一个复杂过程中的第一步。
13. Science:基因编辑大牛张锋教授新成果!在微生物中首次发现新的防御系统:微生物STAND ATPase直接识别病毒蛋白,并杀死受感染的微生物细胞
doi:10.1126/science.abm4096
细菌使用多种防御策略来抵御病毒感染,其中的一些策略已经导致了突破性的技术,如基于CRISPR的基因编辑。科学家们预测,在微生物世界中还有许多抗病毒武器有待发现。
在一项新的研究中,来自美国布罗德研究所和麻省理工学院的研究人员发现了这些未开发的微生物防御系统之一,并确定了它的特征。他们发现,细菌和古生菌---合称原核生物---中的某些蛋白以令人惊讶的直接方式检测病毒,识别病毒的关键部分并导致这些受感染的单细胞生物自杀,以抑制微生物群落中的感染。这项研究是第一次在原核生物中看到这种机制,并表明所有三个生命领域的生物--细菌、古生菌和真核生物(包括植物和动物)---都使用保守的病毒蛋白的模式识别来抵御病原体。相关研究结果发表在2022年8月12日的Science期刊上,论文标题为“Prokaryotic innate immunity through pattern recognition of conserved viral proteins”。
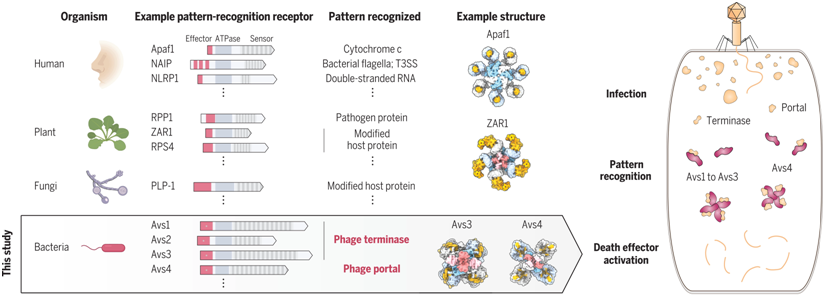
原核生物NLR样防御蛋白的机制与结构。图片来自Science, 2022, doi:10.1126/science.abm4096。
论文通讯作者、布罗德研究所核心成员和麻省理工学院麦戈文研究所研究员张锋(Feng Zhang)教授说,“这项新的研究展示了模式识别如何在非常不同的生物中出现显著的统一性。在一项研究中整合遗传学、生物信息学、生物化学和结构生物学方法,以了解这个迷人的分子系统,这是非常令人兴奋的。”
14. Science:新研究发现透明质酸唤醒肌肉干细胞来修复肌肉损伤
doi:10.1126/science.abm9735
在受损的肌肉中,肌肉干细胞必须与免疫细胞一起工作以完成修复过程,然而这些细胞如何协调以确保在制造新的肌纤维之前有效地清除死亡组织,仍然是未知数。在一项新的研究中,来自加拿大渥太华大学等研究机构的研究人员揭示了控制肌肉修复的一种独特的细胞通信形式。他们发现,一种用于化妆品和骨关节炎注射的叫做透明质酸(hyaluronic acid)的天然物质是控制这种基本相互作用的关键分子。相关研究结果发表在2022年8月5日的Science期刊上,论文标题为“JMJD3 activated hyaluronan synthesis drives muscle regeneration in an inflammatory environment”。
论文通讯作者、渥太华大学教授Jeffrey Dilworth博士说,“当肌肉受损时,免疫细胞迅速进入这种组织并在肌肉干细胞开始修复之前清除损伤是非常重要的。我们的研究显示,肌肉干细胞已准备好立即开始修复,但免疫细胞将这些干细胞维持在静止状态,同时完成清理工作。大约40小时后,一旦清理工作完成,肌肉干细胞的内部警报就会响起,使它们能够醒来并开始修复。”
Dilworth博士及其研究团队确定透明质酸是这个内部警报的关键成分,它告诉肌肉干细胞何时醒来。当肌肉损伤发生时,肌肉干细胞开始产生并给自己涂上透明质酸。一旦这种涂层变得足够厚,它就会阻止免疫细胞的休眠信号,并导致肌肉干细胞醒来。
Dilworth团队利用小鼠和人体组织,还发现了肌肉干细胞如何利用Has2基因上的表观遗传标志控制透明质酸的产生。具体而言,他们确定了表观遗传酶KDM6B/JMJD3在肌肉修复过程中建立肌肉干细胞和浸润免疫细胞之间通信的重要作用。他们发现,在应对肌肉损伤时,KDM6B/JMJD3去除转录抑制性组蛋白修饰H3K27me3,使肌肉干细胞产生透明质酸,然后所产生的透明质酸被整合到肌肉干细胞的胞外基质中。胞外基质的这种重塑使肌肉干细胞能够接受来自浸润免疫细胞的信号,从而启动肌肉再生。
15. Science:揭示IL-17促进受损上皮组织修复机制
doi:10.1126/science.abg9302
损伤损害了我们的上皮屏障,使其容易受到外部威胁。因此,有机体的存活取决于损伤后上皮屏障的快速重建。免疫力低下的人和免疫缺陷的动物均存在着严重的上皮修复缺陷。然而,损伤后免疫-上皮交谈的确切机制和后果仍未完全确定。
上皮修复需要细胞通过进化上保守的缺氧诱导因子(hypoxia-inducible factor, HIF)来适应缺氧的伤口微环境。长期以来,人们认为这种反应取决于上皮细胞对缺氧的自主感应和通过HIF的反应能力。然而,在上皮修复过程中,来自免疫细胞的支持性微环境信号是否以及如何与古老的缺氧反应相互作用,还有待于探索。为了解决这些问题,来自美国纽约大学的研究人员在一项新的研究中着重关注一类主要的上皮屏障---皮肤,它受到免疫细胞的监视,并已进化出复杂的修复机制。相关研究结果发表在2022年7月8日的Science期刊,论文标题为“Interleukin-17 governs hypoxic adaptation of injured epithelium”。
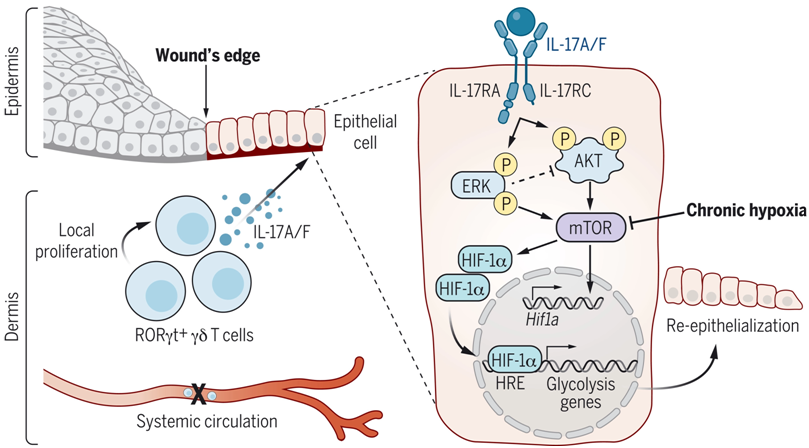
IL-17通过糖酵解驱动上皮细胞HIF1α为伤口修复提供燃料。图片来自Science, 2022, doi:10.1126/science.abg9302。
通过对修复相关的淋巴细胞进行无偏见的分析,这些作者发现了17型淋巴细胞的异质性群体的富集。缺少RORγt+细胞的纯合子Rorgt-EGFP小鼠(下称GFI-KI小鼠)在上皮迁移和伤口再上皮化方面表现出明显的缺陷。损伤后,他们观察到预先存在的皮肤驻留RORγt+细胞出现快速局部扩张,足以驱动修复。在众多伤口RORγt+细胞群体中,空间转录组学和功能研究显示,类先天性γδT细胞(innate-like γδ T cell)通过定位到伤口前沿并促进上皮细胞迁移来指导组织修复。这些类先天性γδT细胞在伤口微环境中主要产生IL-17A/F,它通过IL-17RC直接向上皮细胞发出信号,诱导迁移程序。
16. Science:新研究揭示血细胞中的Y染色体丢失导致男性比女性更早死亡
doi:10.1126/science.abn3100
男性血细胞中的Y染色体丢失与疾病和死亡率有关,但尚未发现明确的因果关系。如今,在一项新的研究中,来自瑞典乌普萨拉大学等研究机构的研究人员发现白细胞中的Y染色体丢失会导致男性心脏纤维化的产生、心脏功能受损和死于心血管疾病。相关研究结果发表在2022年7月15日的Science期刊上,论文标题为“Hematopoietic loss of Y chromosome leads to cardiac fibrosis and heart failure mortality”。
论文共同通讯作者、乌普萨拉大学免疫学、遗传学与病理学系副教授Lars Forsberg说,“在这项新研究使用的小鼠模型中,小鼠的Y染色体被清除,以模拟人类的mLOY状况,我们分析了这所产生的直接后果。对携带mLOY的小鼠的检查显示,心脏中的瘢痕形成(也称为纤维化)增加。我们观察到mLOY导致心脏纤维化,从而导致心脏功能的下降。”
这些作者还能够通过人类流行病学研究来证实小鼠中存在的这一因果效应,在人类中,他们发现mLOY是男性心血管疾病死亡的一个新的重要风险因素。这些人类流行病学研究是利用英国生物样本库(UK Biobank)的数据进行的,英国生物样本库包含了研究开始时50万名年龄在40-70岁的正常老化个体的基因组和健康信息。在研究开始时血液中存在mLOY的男性在大约11年的随访期间,死于心力衰竭和其他类型的心血管疾病的风险增加了约30%。
doi:10.1126/science.abm4012
当涉及到将信息打包到较小的空间时,我们的细胞表现出了工程学的奇迹。每次人类细胞分裂时,它将大约2长的DNA打包成46个小包裹,每个小包裹的长度只有百万分之一米。在一项新的研究中,来自德国欧洲分子生物学实验室海德堡总部(EMBL Heidelberg)和维尔茨堡大学的研究人员如今发现了一个DNA马达蛋白(motor protein)家族如何在细胞分裂过程中成功地将松散排列的DNA链包装成紧凑的染色体。相关研究结果发表在2022年6月3日的Science期刊上,论文标题为“A hold-and-feed mechanism drives directional DNA loop extrusion by condensin”。
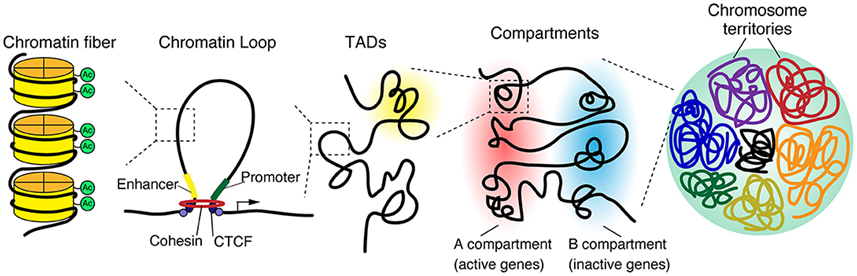
三维基因组结构,图片来自Frontiers in Cell and Developmental Biology, 2021, doi:10.3389/fcell.2020.626541。
这些作者研究了黏连蛋白(cohesin),即一种对染色体形成过程至关重要的蛋白复合物。尽管这种复合物在三十多年前就被发现了,但是它的作用方式在很大程度上仍未被探究。2018年,来自EMBL Heidelberg 的Christian H. Haering团队及其合作者已发现黏连蛋白分子可让细胞基因组产生DNA环(loop),这可能解释了染色体的形成方式。然而,这种蛋白复合物实现这一壮举的内部运作仍然是未知的。
通过精心设计的实验,其中一些实验涉及在黏连蛋白形成DNA环的过程中对它进行观察和操纵,这些作者发现这种蛋白复合物的不同部分如何共同发挥分子机器的作用:一部分像锚一样固定住DNA,而另一部分像马达一样推动DNA前进,从而形成一个较大的DNA环。
像其他马达蛋白一样,黏连蛋白沿着DNA“一步步”前进,在此过程中以ATP的形式燃烧细胞能量。然而,这些步骤要比其他DNA马达蛋白的步骤长500多倍,尽管消耗的能量大致相同。论文第一作者Indra Shaltiel说,“这就像一辆一级方程式赛车和一辆电动自行车的能源效率。”
18. Science:有望取代CRISPR-Cas9的新型基因编辑工具问世!揭示IscB-ωRNA在RNA引导下切割DNA机制
doi:10.1126/science.abq7220
CRISPR开创了基因组医学的时代。从流行的CRISPR-Cas9开发出了一系列强大的工具来治疗遗传疾病。然而,有一个最后一公里的问题:需要有效地将这些工具递送到患者的每一个细胞中,而大多数Cas9太大,无法装入流行的基因组治疗载体,如腺相关病毒(AAV)。
在一项新的研究中,来自康奈尔大学的研究人员为自然界如何解决这个问题提供了一个解释:他们精确地确定了一种转座子衍生性系统如何以RNA引导的方式编辑DNA。转座子是细菌中的可移动的遗传因子。一种转座子编码IscB,IscB的大小不到Cas9的一半,但它同样能够进行DNA编辑。用IscB取代Cas9将明确地解决这种尺寸问题。相关研究结果于2022年5月26日在线发表在Science期刊上,论文标题为“Structural basis for RNA-guided DNA cleavage by IscB-ωRNA and mechanistic comparison with Cas9”。
这些作者利用低温电镜(Cryo-EM)对来自一种转座子系统的IscB-ωRNA分子进行了高分辨率的观察。他们能够捕捉到该系统在不同构象状态下的快照。 他们甚至能够通过去除IscB的非必要部分,设计出尺寸更小的IscB变体。
19. Science:重大进展!发现一种新的微管蛋白去酪氨酸酶---MATCAP
doi:10.1126/science.abn6020
最近,蛋白vasohibin(VASH1和VASH2)与它们的辅助因子小vasohibin结合蛋白(small vasohibin-binding protein, SVBP)一起被确定为去酪氨酸酶。然而,在大多数类型的细胞中,vasohibin的失活并不能消除去酪氨酸化,这表明有一种或多种额外的去酪氨酸酶存在。而其他的微管蛋白修饰是由多个相关的酶组成的大蛋白家族进行的,没有与vasohibin非常相似的蛋白酶。在一项新的研究中,为了确定其他的去酪氨酸酶,来自荷兰癌症研究所的研究人员在单倍体人HAP1细胞中剔除了VASH1和VASH2,并使用微管蛋白酪氨酸化和去酪氨酸化进行全基因组诱变。这些基因筛选的敏感性通过紫杉醇处理或去除TTL来增强,以促进微管蛋白的去酪氨酸化或使酪氨酸裂解不可逆转。相关研究结果发表在2022年5月20日的Science期刊上,论文标题为“Posttranslational modification of microtubules by the MATCAP detyrosinase”。
通过这些基因筛选,这些作者确定了KIAA0895L是一种之前未被发现的去酪氨酸酶,它也是一种未经研究的没有明显蛋白酶特征的蛋白。同时移除KIAA0895L、VASH1和VASH2会导致体外培养的细胞中微管蛋白去酪氨酸化水平无法检测到。KIAA0895L的晶体结构显示了一种非典型的属于gluzincins家族的金属蛋白酶褶皱(新型冠状病毒SARS-CoV-2受体ACE2也属于gluzincins家族)。KIAA0895L由于一个简并签名基序(HExxxH而不是HExxH)中断了含有活性位点的螺旋,而没有对催化位点排列的完整性产生实质性的影响,所以没有被注释为蛋白酶。这些作者将这种蛋白重新命名为MATCAP(microtubule-associated tyrosine carboxypeptidase, 微管相关酪氨酸羧肽酶)。

微管蛋白去酪氨酸化是由不同的MATCAP和vasohibin去酪氨酸酶进行的。图片来自Science, 2022, doi:10.1126/science.abn6020。
MATCAP和vasohibin采用了非常不同的催化策略(前者是金属蛋白酶,后者是半胱氨酸蛋白酶)来靶向α-微管蛋白的尾部。此外,vasohibin的裂解依赖于EEY末端基序中的倒数第二个谷氨酸,并且只容忍化学上相关的苯丙氨酸替代α-微管蛋白末端的酪氨酸,而MATCAP对这种末端氨基酸残基的性质是混杂的,并且显示出对也位于更上游的α-微管蛋白尾部氨基酸残基的依赖性,以进行底物识别。无催化活性的MATCAP与完全酪氨酸化的微管结合在一起时的低温电镜结构表明,MATCAP识别同一微管原纤维(microtubule protofilament)中的微管蛋白二聚体,而VASH1-SVBP复合物位于相邻的微管原纤维之间。出乎意料的是,通过基因手段剔除小鼠中的MATCAP和SVBP导致它们的可存活下来的后代具有检测不到的去酪氨酸化水平。尽管这些小鼠后代可存活下来,但是它们在神经发生过程中显示出大脑形态上的缺陷伴随着增殖缺陷,并表现出异常的行为。
20. Science:挑战常规!细胞基因组中的一些DNA环并不长期持续存在
doi:10.1126/science.abn6583
在人类染色体中,DNA被蛋白包裹,形成一条超长的串珠线。这条串珠线经折叠后形成许多环(loop),据信这些环有助于细胞控制基因表达和促进DNA修复,以及其他功能。在一项新的研究中,来自麻省理工学院、马克斯-普朗克分子细胞生物学与遗传学研究所的研究人员发现,这些环是非常动态的,而且比以前认为的寿命更短。相关研究结果发表在2022年4月15日的Science期刊上,论文标题为“Sphingolipids control dermal fibroblast heterogeneity”。
在这项新的研究中,这些作者能够在大约两个小时的时间里监测活细胞中的一段基因组---Fbn2拓扑关联结构域(topologically associating domain, TAD)---的运动。他们观察到这段基因组只有3%到6%的时间是完全成环的(即形成环状结构),所形成的环只持续了大约10到30分钟。这些发现表明科学家们目前对DNA环如何影响基因表达的理解可能需要修正。
这些作者用他们的方法对小鼠胚胎干细胞中的一段基因组进行成像。论文共同第一作者、麻省理工学院研究生Simon Grosse-Holz说,“如果我们把我们的数据放在一个持续约12小时的细胞分裂周期的背景下,完全形成的DNA环实际上只存在约20至45分钟,仅占约3%至6%的时间。”
21. Science:重大进展!将大鼠多能性干细胞成功诱导为原始生殖细胞样细胞,并培育出健康的大鼠后代
doi:10.1126/science.abl4412
利用多能性干细胞(pluripotent stem cell, PSC)在体外产生生殖细胞,对未来的生殖医学和动物育种有很大的影响。在一项新的研究中,来自日本多个研究机构的研究人员成功地利用在体外产生的大鼠生殖细胞培育出大鼠后代。相关研究结果发表在2022年4月8日的Science期刊上,论文标题为“Functional primordial germ cell–like cells from pluripotent stem cells in rats”。在这篇论文中,他们描述了他们的方法,并解释了为什么他们认为他们的研究工作将导致对其他物种的体外配子发生的更好理解。

优化诱导大鼠PGCLC产生的方法,图片来自Science, 2022, doi:10.1126/science.abl4412。
在2011年,2011年,已有一个研究团队开发出一种将小鼠多能性干细胞分化为能够进行配子发生的原始生殖细胞样细胞(primordial germ cell-like cell, PGCLC)的方法,从而在体外重建小鼠生殖细胞特化,更具体地说,开发出一种利用小鼠多能性干细胞产生小鼠精子样细胞(sperm-like cell)的方法,然后用这些精子样细胞使一只雌性小鼠受孕并生下健康的幼鼠。自那时起,已经有许多科学家试图在另一个物种中重复这一壮举,但是在此之前诱导PGCLC在体外产生配子还没有在任何其他物种中实现。这表明实现这一过程可能是多么困难。在这项新的研究中,这些作者以早前的研究为模板,在大鼠身上复制了这一过程。
该过程首先诱导大鼠胚胎干细胞产生胚胎中的上胚层样细胞(epiblast-like cell)。这些作者随后将产生的上胚层样细胞放在含有信号分子和其他成分的培养基中,促进它们转变为大鼠PGCLC。接下来,PGCLC与促进它们成熟和表观遗传重编程的性腺体细胞一起培养,这是模拟正常成熟过程的一种手段。一旦PGCLC成熟了,它们就被移植到一只经过改造后没有生殖细胞的雄性大鼠的睾丸生精小管中。他们让它们自然发育为成熟的精子。他们随后从这只雄性大鼠身上取出精子样本,并将它们直接注射到一只活的雌性大鼠的卵母细胞中,该雌性大鼠生下了健康的后代。他们指出,这些后代成长并能够自然繁殖。
doi:10.1126/science.abf0529
从细菌、真菌到植物和动物,铜都是生命的一个重要元素。在人类中,它与酶结合以协助于血液凝固、激素成熟和细胞处理能量。但是过多的铜会杀死细胞,如今科学家们找到了其中的原因。
在一项新的研究中,来自美国布罗德研究所的研究人员发现一种由铜诱导的新形式的细胞死亡。在布罗德研究所研究员Peter Tsvetkov和布罗德研究所主任Todd Golub的领导下,这些作者发现铜与专门的蛋白结合,导致它们形成有害的团块,并且还干扰了其他必需蛋白的功能,这会使得细胞进入毒性应激状态并最终死亡。相关研究结果发表在2022年3月18日的Science期刊上,论文标题为“Copper induces cell death by targeting lipoylated TCA cycle proteins”。
通过揭示这一过程的关键组成部分,这项新的研究还确定了哪些细胞特别容易受到铜诱导的死亡。这些发现可能有助于科学家们更好地了解出现铜失调的疾病,甚至可以为开发新的癌症治疗方法提供参考。
23. Science:25年谜团终揭晓!揭示NAC蛋白复合物调节新生蛋白在细胞内的运输
doi:10.1126/science.abl6459
在一项新的研究中,来自德国康斯坦茨大学、瑞士苏黎世联邦理工学院和美国加州理工学院的研究人员解决了一种已存在25多年的难题:细胞中蛋白如何分选。一种称为NAC(nascent polypeptide-associated complex, 新生多肽复合物)的蛋白复合物在蛋白合成中充当“守门员”,调节着蛋白在细胞内的运输。他们阐明了这种功能背后的分子机制。相关研究结果发表在2022年2月25日的Science期刊上,论文标题为“Mechanism of signal sequence handover from NAC to SRP on ribosomes during ER-protein targeting”。
为了维持我们的细胞功能,当蛋白仍在合成时,就必须将它们运输到细胞中多种称为“细胞器”的目的地。但是,如何才能区分不同的运输目的地并防止蛋白到达错误的细胞器呢?这些作者如今发现了为了使蛋白运输到一个重要的细胞目的地---将新生的蛋白运送到细胞中的一种膜网络,即内质网,这种复杂的过程如何在分子水平上受到控制。
在这项新的研究中,这些作者能够发现一种被专家们称为NAC的蛋白质复合物在这一过程中起着决定性的作用,该复合物是在25年前发现的。像守门员那样,NAC确保只有以内质网为目的地的蛋白被传递给蛋白转运体SRP(signal recognition particle, 信号识别颗粒)。然后SRP介导这种蛋白“货物”运输到指定的目的地。另一方面,如果新生蛋白的目的地不是内质网,守门员NAC会拒绝蛋白转运体SRP的访问。
24. Science:震惊!在荷兰发现一种新的高毒性的HIV毒株---VB变体
doi:10.1126/science.abk1688
正如正在进行的冠状病毒SARS-CoV-2大流行所证明的那样,病毒基因序列的新突变可以对病毒的传播性和造成的损害产生重大影响。多年来,人们一直担心HIV-1病毒会出现这种情况。根据联合国艾滋病规划署的统计数据, HIV-1已经影响到全球3800万人,迄今已造成3300万人死亡。
在一项新的研究中,英国牛津大学大数据研究所的研究人员领导的一个研究团队证实在荷兰发现了一种新的、高毒性的称为VB变体(VB variant)的HIV毒株。相关研究结果发表在2022年2月4日的Science期刊上,论文标题为“A highly virulent variant of HIV-1 circulating in the Netherlands”。
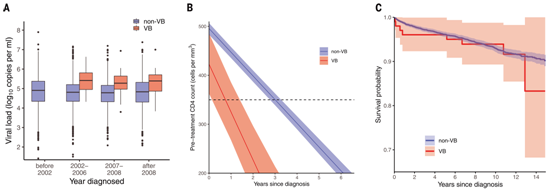
VB变体感染者的临床特点。图片来自Science, 2022, doi:10.1126/science.abk1688。
在接受抗逆转录病毒治疗(ART)之前,感染了这种VB变体的人与感染了其他HIV变体的人相比显示出明显的差异:(1)感染VB变体的人的病毒载量(血液中的病毒水平)高出3.5到5.5倍;(2)此外,感染VB变体的人体内CD4 T细胞减少的速度(这是HIV对免疫系统造成损害的标志)比其他HIV变体快两倍,使这些感染者更快面临发展为艾滋病(AIDS)的风险;(3)感染VB变体的人还显示出将这种病毒传播给他人的风险增加。
令人欣慰的是,在开始治疗后, VB变体感染者的免疫系统恢复和生存率与其他HIV变体患者相似。然而,这些作者强调,由于VB变体导致免疫系统强度更快速的下降,这使得感染者尽早被诊断并尽快开始治疗变得至关重要。
25. Science:挑战常规!揭示DNA结合蛋白高效结合DNA靶序列的新机制
doi:10.1126/science.abg7427
在一项新的研究中,来自瑞典乌普萨拉大学的研究人员展示了DNA结合蛋白如何在不受到阻碍的情况下在整个基因组中搜索它的靶序列。这一结果与我们目前对基因调控的理解------遗传密码影响DNA结合蛋白的结合频率,但不影响它的结合时间---相矛盾。相关研究结果发表在2022年1月28日的Science期刊上,论文标题为“Sequence specificity in DNA binding is mainly governed by association”。
当DNA结合蛋白在遗传密码中寻找它们的靶序列时,它们沿着DNA螺旋滑动以加快这一过程。当它们最终找到正确的位置时,它们停留在那里;与“正确的”靶序列的相互作用阻止了它们的滑行。这一机制已被广泛接受来描述这一搜索过程。这确是一个吸引人的假说,但它提出了一个恼人的问题---DNA代码中充满了许多“几乎正确”的序列。如果DNA结合蛋白在特定的DNA基序上停留的时间是由序列决定的,那么执行搜索任务的DNA结合蛋白将不断地在与它们的靶序列相似的序列上逗留。
论文第一作者、乌普萨拉大学的Emil Marklund说,“如果教科书上的解释是正确的,那么DNA结合蛋白会一直停留在靶序列之外。基因调控将非常无效,但我们从以前的研究中知道,情况并非如此。我们最熟悉的DNA结合蛋白LacI在几分钟内就能在460万个碱基对中找到它的靶序列。”
为了解决这一悖论,这些作者让DNA结合蛋白LacI在安装在一个微芯片上的数千个不同的DNA序列上来回滑动。一种荧光分子附着在LacI蛋白上,使得测量LacI附着在不同DNA序列上的速度以及它从中释放下来的速度成为可能。所获得的结果是令人吃惊的。与之前的假设相反,DNA序列对LacI与DNA结合的时间几乎没有影响。然而,当遇到的DNA序列与靶序列相似时,滑动的LacI更有可能短暂地停留下来。换句话说,DNA结合蛋白经常也会离开它们要调节的序列,但是在靶位点,它们总是在找到它们的路径之前进行非常短的旅程。在宏观的时间尺度上,这看起来是一种稳定的相互作用。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


