新冠疫情:1349万!辉瑞/BioNTech 2款在研mRNA疫苗获美国FDA授予快速通道资格!
来源:本站原创 2020-07-15 20:33
2款疫苗分别编码优化的SARS-CoV-2受体结合域(RBD)抗原和全长棘突蛋白(S)抗原。
2020年07月15日讯 /生物谷BIOON/ --目前,新冠肺炎疫情仍在全球迅速蔓延。根据百度《新型冠状病毒肺炎疫情实时大数据报告》,截止2020年07月15日20时,全球累计确诊超过1349.5万例,死亡超过58.2万例。
辉瑞与BioNTech近日联合宣布,来自双方BNT162 mRNA疫苗项目4个候选疫苗中的2个疫苗(BNT162b1和BNT162b2)获得美国食品和药物管理局(FDA)授予快速通道资格(FTD),这些疫苗正处于临床开发,用于预防新型冠状病毒(SARS-CoV-2),该病毒感染可导致新型冠状病毒肺炎(COVID-19)。

BNT162b1和BNT162b2是BNT162疫苗项目中最先进的2种候选疫苗,正在美国和德国开展的1/2期临床研究中进行评估。大规模全球2b/3期安全性和有效性研究预计最早在7月份启动。
快速通道(Fast Track)是一个旨在促进新药和疫苗开发和加速审查的程序,这些新药和疫苗旨在治疗或预防有潜力解决未满足医疗需求的严重疾病。
FDA授予FTD认定,是根据目前在美国和德国进行的1/2期研究的初步数据以及动物免疫原性研究数据。2家公司于2020年7月1日发布了正在进行的候选疫苗BNT162b1美国1/2期研究的早期数据。文章手稿可在在线预印本网站medRxiv上获得(Phase 1/2 Study to Describe the Safety and Immunogenicity of a COVID-19 RNA Vaccine Candidate (BNT162b1) in Adults 18 to 55 Years of Age: Interim Report),同时正在进行科学同行评审,以备发表。BNT162b1德国试验的早期数据预计将于7月公布。
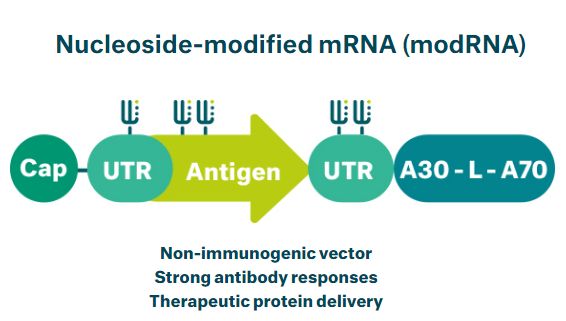
BNT162疫苗项目正在评估至少4种研究性疫苗,每种疫苗都代表了信使RNA(mRNA)格式和目标抗原的独特组合。BNT162b1和BNT162b2均为核苷修饰的mRNA(modRNA),包裹在脂质纳米粒中。BNT162b1编码一个优化的SARS-CoV-2受体结合域(RBD)抗原,而BNT162b2编码一个优化的SARS-CoV-2全长棘突蛋白(S)抗原。
辉瑞全球监管事务高级副总裁Peter Honig表示:“FDA授予这2种候选疫苗快速通道资格的决定,标志着研发安全有效SARS-CoV-2疫苗的一个重要里程碑。我们期待着在这个项目的临床开发过程中继续与FDA密切合作,以评估这些候选疫苗的安全性和有效性。”
BioNTech首席医疗官Özlem Türeci表示:“我们很高兴收到FDA授予我们2个候选疫苗快速通道资格,并期待着与FDA以及我们的合作伙伴辉瑞公司密切合作,加快推进临床研发。”
这项名为“光速计划”(Project Lightspeed)的疫苗开发项目,是基于BioNTech专有的mRNA技术平台,并得到辉瑞全球疫苗开发能力的支持。BNT162候选疫苗正在进行临床研究,目前尚未批准在世界任何地方分发。辉瑞和BioNTech致力于开发这些新型疫苗,将临床前和临床数据放在两家公司所有决策的最前沿。
取决于监管部门的批准,2家公司预计最快将于本月晚些时候启动2b/3期试验,并预计将招募多达3万名受试者。如果正在进行的研究取得成功,并且候选疫苗获得监管部门的批准,双方目前预计到2020年底将生产多达1亿剂疫苗,到2021年底可能生产超过12亿剂。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


