2021年4月Cell期刊不得不看的亮点研究
来源:本站原创 2021-04-30 14:45
2021年4月30日讯/生物谷BIOON/---2021年4月份即将结束了,4月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。1.Cell:重大进展!实验性药物CA激活分子伴侣介导的自噬,有潜力治疗阿尔茨海默病doi:10.1016/j.cell.2021.03.048在一项新的研究中,来自美国阿尔伯特-爱因斯坦医学院的研究人员设
2021年4月30日讯/生物谷BIOON/---2021年4月份即将结束了,4月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:重大进展!实验性药物CA激活分子伴侣介导的自噬,有潜力治疗阿尔茨海默病
doi:10.1016/j.cell.2021.03.048
在一项新的研究中,来自美国阿尔伯特-爱因斯坦医学院的研究人员设计出一种实验性药物,它可以在小鼠体内逆转阿尔茨海默病的关键症状。该药物通过重新激活一种消化和循环利用不需要的蛋白以去除它们的细胞清理机制而起作用。相关研究结果于2021年4月22日在线发表在Cell期刊上,论文标题为“Chaperone-mediated autophagy prevents collapse of the neuronal metastable proteome”。
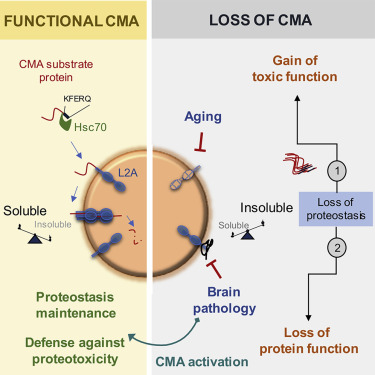
激活CMA可维持蛋白稳态和抵抗蛋白毒性,图片来自Cell, 2021, doi:10.1016/j.cell.2021.03.048。
随着人们年龄的增长,CMA的效率越来越低,这就增加了不需要的蛋白积累成损害细胞的不溶性团块的风险。事实上,阿尔茨海默病和所有其他神经退行性疾病的特点是在患者的大脑中存在有毒的蛋白聚集物。这些作者在这项研究中揭示了CMA和阿尔茨海默病之间的动态相互作用,神经元中CMA的丧失可促进阿尔茨海默病,反之亦然。这些发现表明,激活CMA的药物可能为治疗神经退行性疾病带来希望。
这些作者首先研究了CMA受损是否会导致阿尔茨海默病。为此,他们对小鼠进行了基因改造,使之具有缺乏CMA的兴奋性大脑神经元。这种脑细胞中的CMA缺失足以导致短期记忆丧失、行走障碍,以及在阿尔茨海默病的啮齿类动物模型中经常发现的其他问题。此外,CMA的缺失极大地破坏了蛋白稳态(proteostasis)---细胞调节它们所含蛋白的能力。正常情况下可溶性的蛋白已经转变为不可溶性,并有风险形成有毒的聚集物。
在其中的一项令人鼓舞的发现中,这些作者开发了一种新型药物,它显示出治疗阿尔茨海默病的潜力。他们知道CMA能够降解有缺陷的tau和其他蛋白,但是阿尔茨海默病和其他神经退行性疾病中大量的缺陷蛋白使CMA不堪重负,基本上使其瘫痪。这种药物通过提高一种关键的CMA成分的水平来重新提升CMA的效率。
在CMA中,称为分子伴侣的蛋白与体内细胞中受损或有缺陷的蛋白结合。分子伴侣将它们的货物运送到细胞的溶酶体。溶酶体是一种有膜细胞器,它含有的酶消化和循环利用废弃物。然而,为了成功地将它们携带的货物送入溶酶体,分子伴侣必须首先将货物“对接”到一种名为LAMP2A的蛋白受体上,该受体从溶酶体的膜上长出。溶酶体上的LAMP2A受体越多,潜在的CMA活动水平就越高。这种名为CA的新型药物通过增加这些LAMP2A受体的数量而发挥作用。
2.Cell:重大进展!中美科学家成功在体外利用构建出人-猴嵌合胚胎
doi:10.1016/j.cell.2021.03.020
在一种物种的有机体内生长另一种物种的细胞的能力为科学家们提供了一个强大的用于研究和医学的工具。这种方法可以促进我们对人类早期发育、疾病发生和进展以及衰老的理解;为药物评估提供创新平台;并解决对可移植器官的关键需求。然而开发这样的工具一直是一个艰巨的挑战。在一项新的研究中,来自中国昆明理工大学和美国沙克生物学研究中心等研究机构的研究人员通过展示一种新的将人类细胞整合到动物组织中的方法,向这一目标迈进了一步。这为了解一系列疾病并解决供体器官的严重短缺问题奠定基础。相关研究结果发表在2021年4月15日的Cell期刊上,论文标题为“Chimeric contribution of human extended pluripotent stem cells to monkey embryos ex vivo”。
据世界卫生组织(WHO)估计,每年进行的13万例器官移植手术只占需求的10%,而可用器官的短缺更加剧了这一需求。鉴于猪的器官大小、生理学和解剖学与人类相似,科学家们希望在猪组织中生长人类细胞可能能够解决这一问题。此前,在2017年的研究中,沙克生物学研究中心的科学家们报告了他们的突破性研究工作:他们将人皮肤细胞重编程为诱导性多能干细胞(iPS),然后将ips细胞暴露于某种分子混合物中,从而将它们转化为潜能扩展的人多能性干细胞(extended pluripotent stem cell, EPS),而所产生的EPS细胞可产生更多类型的组织;他们将EPS细胞整入早期阶段的猪组织中,标志着利用大型动物生产可移植人类器官的第一步(Cell, 2017, doi:10.1016/j.cell.2016.12.036; Cell, 2017, doi:10.1016/j.cell.2017.02.005)。但人体细胞的贡献相当低,这可能是由于两个物种之间的进化距离很大(9000万年)。于是,在这项新的研究中,这些作者开始在一种关系更密切的物种---食蟹猴---中研究嵌合体形成。
这些作者用荧光蛋白标记了人EPS干细胞(能够发育成体内所有细胞类型的细胞),并将这些标记的干细胞插入到培养皿中的食蟹猴胚胎内。这项新的研究得益于他们去年发表的技术,该技术使得猴子胚胎能够在体外长时间保持活力和生长(Science, 2019, doi:10.1126/science.aaw5754)。在这项新的研究中,所有的实验都在干细胞注射19天后终止。通过让抗体与荧光标记的EPS干细胞结合,他们观察到人类干细胞的存活和整合效率比之前在猪组织中的实验相对要好。
在这项新的研究中,这些作者在食蟹猴身上测试了这些EPS细胞。他们将25个人EPS干细胞分别插入132个食蟹猴胚胎中,并将所获得的嵌合体在培养皿中培养长达20天。他们发现,人类细胞显示出了持久的能力:13天后,它们仍然存在于三分之一的嵌合体中。人类细胞似乎与食蟹猴细胞融合在一起,并已开始特化为将发育成不同器官的细胞类型。
为了确定这两种物种的细胞之间的分子沟通途径,这些作者分析了这种嵌合体的转录组。他们观察到来自嵌合体组织的细胞具有与对照组不同的转录组图谱,并检测到在嵌合体细胞中有几条增强的或新的分子沟通途径。这些途径可能促进了人细胞和食蟹猴细胞之间的融合。操纵其中的一些途径可能会帮助人类细胞在“更适合再生医学”的物种胚胎中存活。
3.Cell: 癌细胞RAS信号传递如何不依赖于细胞膜就可实现?
doi:10.1016/j.cell.2021.03.031
酪氨酸激酶(RTK)介导的下游效应途径的活化,例如RAS GTPase / MAP激酶(MAPK)信号级联反应,被认为仅发生于哺乳动物细胞中的脂膜区。在最近一项研究中,来自美国加州旧金山分校的Trever G. Bivona团队发现了一种基于蛋白质颗粒的无膜亚细胞结构,可以组织癌症中的RTK / RAS / MAPK信号传导。相关结果发表在《Cell》杂志上。
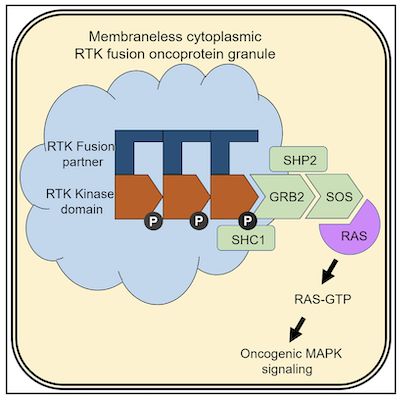
图片来自Cell, 2021, doi:10.1016/j.cell.2021.03.031。
进一步,作者通过成像手段发现EML4-ALK无膜细胞质蛋白颗粒能够在原位募集RAS激活复合物GRB2 / SOS1 / GAB1,并且能够激活下游的RAS信号。在此基础上,作者发现当这一无膜复合体具备高度有序特征时,其在不依赖细胞膜结构的情况下依然能够激活下游的RAS/MAPK,而低有序度的蛋白复合体则不具备上述能力。
综上,作者通过一系列精巧的设计以及高分辨率成像实验,发现了由RTK形成的全新细胞内蛋白质颗粒结构,并建立了定义RTK癌蛋白形成无膜蛋白颗粒的结构规则。该发现揭示了无膜的、高有序度胞质蛋白符合体是致癌RTK和RAS信号传导的独特亚细胞平台。
4.Cell: 新型CRISPR转录组学编辑“机器”有助于重塑转录组记忆
doi:10.1016/j.cell.2021.03.025
基因编辑技术的进步大幅提升了我们修饰人类基因组的能力。基于sgRNA介导的CRISPR- Cas9相关基因编辑技术能够在指定位点引入DNA断裂以失活基因功能或通过同源性DNA修复引导精确的DNA编辑,这些技术已针对基础DNA序列的靶向变化进行了优化,因此非常适合修复或引入致病性突变。然而,上述技术对内源性DNA修复机制的依赖提出了挑战,因为这些途径的复杂性可能使其难以进一步提升精确性。
最近的工作表明,表观基因组编辑有可能编写一种稳定的转录程序,该程序可以被人类细胞记住并传播,而无需可编程表观遗传调节剂的组成型表达。 此外,可以通过募集DNA甲基转移酶和KRAB结构域的混合物来沉默基因。然而,迄今为止,表观遗传记忆编写程序仅对少数内源性人类基因进行了沉默测试。此外,以前的可编程表观遗传沉默子设计为每个靶基因使用两个或三个融合蛋白,这在实验操作上很麻烦(尤其是对于多重基因靶向),从而使得基因靶向策略更加复杂。此外,基于TALE的KRAB与DNMT3A和DNMT3L结构域的融合导致基因沉默效率的长期低下。目前尚不清楚这些方法对于建立具有“遗传性”的基因沉默技术的通用性以及是否存在编写和维持可遗传表观遗传沉默程序所需的基因组特征。对此,一个合理的假设是:由单个失活Cas9融合蛋白组成的表观遗传编辑元件将有助于广泛地探索“可遗传”表观遗传基因沉默技术的实用性。
在最近发表在《Cell》杂志上的一项研究中,来自UCSF的Jonathan S. Weissman团队介绍了一种名为“CRISPRoff”的技术,包括其设计理念,开发过程和技术验证,CRISPRoff是一种可编程的表观遗传记忆编写器蛋白,可以持久抑制基因表达。研究发现,CRISPRoff的瞬时表达编写了一种表观遗传程序,从而维持人类细胞450多次的细胞分裂,突显出这种形式的基因沉默是稳定且可遗传的。 CRISPRoff表观遗传记忆可以使用称为CRISPRon的多部分表观遗传编辑器进行逆转,该编辑器可特异性删除DNA的甲基化修饰并募集转录元件。
使用全基因组CRISPRoff筛选,作者证明了这种方法可以持久且特异性地沉默绝大多数蛋白质编码基因,并且具有广泛的靶向性。此外,对于CRISPRoff介导的稳定基因沉默而言,规范的CpG岛标签不是必需的。
最后,作者证明了CRISPRoff可用于在人类干细胞中介导沉默增强和工程化的基因沉默程序,这些程序在神经元的不断分化过程中持续存在。总而言之,该系统使研究者们能够广泛探索表观遗传沉默的生物学规则,并提供了一个强大的工具来控制基因表达,靶向增强子以及探索表观遗传的原理。
5.Cell: 肠道微生物组长期的遗传稳定性与个体特异性
doi:10.1016/j.cell.2021.03.024
人的肠道具有多种多样的微生物群落,它们之间存在较大差异。此前的交叉-横断面分析已将这些变异与人类健康和疾病表型相关联。肠道微生物群也会在个体的生命过程中发生变化,该变化与宿主健康和疾病状况之间存在互为因果的多重联系。此前多项研究评估了微生物分类学组成的时间变化,并为针对宿主与微生物组串扰对健康和疾病的后果进行针对性的机制性研究奠定了基础,包括早期的研究儿童期,早发1型和2型糖尿病和炎症性肠病等。
然而,关于肠道微生物组的时间变化趋势的几个重要问题仍需要得到进一步揭示。首先,除了肠道微生物组成外,微生物基因组的遗传组成也会随时间动态变化。物种演化和菌株替代导致的微生物基因组变化,例如单核苷酸突变和基因组区域的获得或丢失,与人类疾病的发展有关。然而,关于微生物遗传组成的时间变化的研究仍然缺乏。其次,尽管横断面关联分析报告了许多与宿主健康和疾病之间存在关联的微生物群组特征,但其普遍缺乏纵向(即时序性)验证。第三,鉴于近几十年来抗生素的广泛使用,包括抗生素耐药性和毒力因子等在内的其它细菌衍生物已成为主要关注的问题。然而,相关微生物衍生物随时间的变化趋势尚无得到清晰揭示,这阻碍了细菌感染的有效预防和治疗。
对此,在最近发表在《Cell》杂志上的一项研究中,来自荷兰格罗宁根大学的Jingyuan Fu课题组对囊括338位志愿者的Lifelines-DEEP、队列进行了肠道微生物组的长期随访分析,比较了相隔4年的样本。作者表征了肠道微生物组成和遗传组成的长期时间稳定性,并试图回答以下两种类型的问题:(1)哪些细菌特征既具有个体特异性又具有时间稳定性?是否可以将这些功能用作“指纹”来区分同一个人的样本? (2)哪些细菌特征表现出较大的时间变化?它们的时间变化是否可以与宿主的临床表型和生活方式的变化联系在一起?
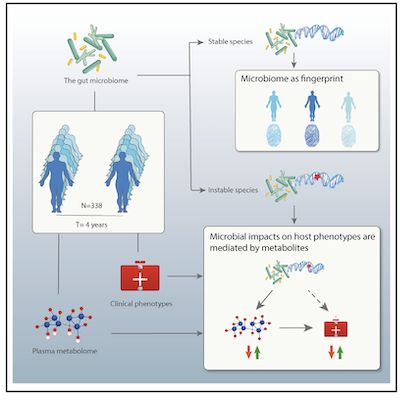
图片来自Cell, 2021, doi:10.1016/j.cell.2021.03.024。
为了研究人类肠道微生物组的长期变化,作者以4年为间隔期收集了338个个体的粪便样本,并对这些样本进行了处理。使用相同的实验室提取以及生物信息分析方法,在前后两个时间点评估了51个表型因素,包括人体测量学特征(例如年龄,性别和体重指数[BMI]),血细胞计数,生化指标(例如葡萄糖,HbA1c和血脂谱),疾病,和药物使用情况。对于22个连续性状,作者观察到19个表型因子随时间发生显著变化。例如,作者观察到血浆肌酐水平,收缩压和舒张压显著增加。此外,作者还调研了参与者的生活方式,疾病和药物使用的变化。例如,有26名参与者患上肠易激综合症(IBS),而有6名参与者患上了抑郁症。
为了表征肠道微生物组随时间的稳定性,作者首先研究了微生物的组成和多样性。与基线相比,我们观察到随时间变化微生物组α-多样性显著增加,微生物种类和“途径丰度”也发生一定程度的变化。个体之间的整体微生物种类和途径组成的差异大于个体内部的差异,表明个体的肠道微生物组成与其4年前的自身组成相比变化相对不大。此外,作者发现基线水平α-多样性较高的参与者中肠道微生物种类组成的个体内差异较小,暗示了不同的微生物群落倾向于更稳定的状态。
当比较单个微生物的种类和途径时,在FDR <0.05时,相对丰度达59.9%种类(157种中的94种)和44.3%途径(343种中的152种)显示出显著差异。属于同一属的物种通常显示方向一致的变化,例如7个双歧杆菌物种的相对丰度都显著降低,而大多数阿利培斯物种(8个中的7个)的丰度都增加了。这些变化可能部分是由于年龄的影响。例如,已经观察到包括双歧杆菌,双歧双歧杆菌和长双歧杆菌在内的几种双歧杆菌菌株与年龄呈负相关。
6.Cell:科学家浅谈在细胞迁移或分化过程中,细胞外信号是如何整合的?
doi:10.1016/j.cell.2021.02.045
来自牛津大学惠康人类遗传学中心结构生物学科的Christian Siebold教授带领团队,在《Cell》杂志上发表了题为"Simultaneous binding of Guidance Cues NET1 and RGM blocks extracellular NEO1 signaling"的研究论文。
长期以来,NET1的“主要”受体被认为是DCC。然而,最近的研究表明,NET1可以通过NEO1介导化学吸引反应。该研究团队的二元NET1-NEO1复杂结构类似于二元DCC-NET1复杂的整体架构,揭示了两个高度保守的界面,NET1与DCC/NEO1-FN4结构域的高亲和力相互作用位点和与DCC/NEO1-FN5结构域的低亲和力相互作用,这两者都是至关重要的。这两种结果都表明NET1介导的DCC/NEO1聚类对于下游信号传导是重要的。该研究团队对二元NET1受体复合物的分析支持NET1与NEO1和DCC之间信号激活的保守结合模式和机制。
NEO1是具有各种相互作用和信号输出的多域受体。NEO1寡聚化是信号传导所必需的,二元 NEO1:RGM信号传导兼容的复合物触发生长锥塌陷和细胞排斥。这个过程可以通过BMP形态发生素加强,RGM作为桥接BMP和NEO1的物理连接,诱导NEO1聚类。NET1与NEO1或NEO1直向同源物DCC的结合可以引发有吸引力的指导反应,并且NET1-DCC结合诱导受体聚集。在该研究中,该研究团队显示二元NET1-NEO1复合体表现出类似的方式,表明NET1诱导的化学吸引是由NEO1受体聚类触发的。尽管两种配体都结合在近膜FN4-6区域,但该研究团队的数据显示RGM和NET1同时靶向NEO1上独立的保守结合位点并触发与二元 NEO1-RGM和成簇的NET1-NEO1寡聚体不相容的独特受体构象域。这在细胞表面的NET1-NEO1和NEO1-RGM复合物之间形成了一个“十字路口”,其中NEO1-NET1-RGM“三聚体”超复杂地微调了该基本信号通路的输出。在这种情况下,两个功能竞争的配体(NET1和RGM)通过形成沉默复合物来阻断NEO1信号传导。
该研究团队以前的研究结果表明,RGMB对DCC的结合亲和力比NEO1低约1000倍。尽管与NEO1最小RGM结合区(NEO1-FN5-6)具有超过80%的相似性,但DCC缺乏NEO1-FN5中存在的RGM界面环,因此充当NEO1-RGM结合的特异性决定因素。与缺乏生理学相关的DCC-RGM相互作用一致,在该研究中该研究团队显示在CNs中敲除DCC对RGMA诱导的生长锥塌陷没有影响,也没有影响NET1调节这种效应的能力。DCC缺失不影响NET1介导的SVZ成神经细胞迁移,也不影响RGMA或RGMB抑制这种作用的能力。这支持RGM抑制可能归因于三元NEO1-NET1-RGM复合物的观点。NEO1与DCC一起的不同进化可以通过信号转导中对三元NEO1-NET1-RGM复合物的需求来解释,其与DCC分开以特异性调节RGM信号传导的抑制。
RGM和NET1表达模式经常重叠,例如在神经管闭合期间或在更发达的中枢神经系统中。最初的工作意味着NEO1上NET1和RGMA之间的竞争性结合。与此相反,该研究团队的数据表明两个配体都可以同时结合NEO1形成“沉默”复合物,从而阻断下游信号传导和功能。该研究团队的研究和其他人的工作均支持这样一个模型,其中这个三元复合体对于调节和微调NEO1-NET1-RGM信号输出是重要的。例如,以前的研究表明,NET1可以抑制RGMA对迁移皮层中间神经元的排斥作用。
7.Cell:重磅!科学家利用单细胞测序研究人类心脏发育
doi:10.1016/j.cell.2019.11.025
人类心脏起源于中胚层,发育成心管,在受孕后21天左右开始跳动。30天后心管循环,形成四个单独的心腔和心外膜。随后,流出道(OFT)分化,心室肌外侧部分转化为致密心肌和间隔。最终,OFT分为主动脉和肺动脉,大部分的心脏间隔在妊娠早期结束时完成。这些复杂的事件是复杂和适时的基因表达相互作用的结果,这些相互作用与作用于发育中心脏的每个部分的空间和功能程序有关。鼠类和人类心脏发育之间存在差异。因此,需要对人类发育组织进行空间解析的单细胞转录数据。
基于此,瑞典皇家理工学院基因技术系主任Joakim Lundeberg教授带领团队提出了一种分子方法,揭示了在胚胎心脏的三个发育阶段细胞类型的综合转录图谱,并将细胞类型特异性基因表达映射到特定的解剖结构域。该项工作以“A Spatiotemporal Organ-Wide Gene Expression and Cell Atlas of the Developing Human Heart”为题发表在《Cell》上杂志。

6.5–7 PCW人胚胎心脏的单细胞分析, 图片来自Cell, 2021, doi:10.1016/j.cell.2019.11.025。
接下来,研究人员使用单分子RNA荧光原位杂交(smFISH)交叉验证了三个ISS基因探针的结果,其产生的模式与测序观察到的模式相似。研究人员将ISS的亚细胞空间分辨率应用于ST分析的三个心脏组织。设计一个基因面板,利用来自两个匹配的6.5–7 PCW生物样本的ST和scRNA序列分析的信息。他们还发现了空间细胞映射证实了ST预测的团簇的空间分布,并解析了由彼此靠近的不同细胞类型形成的更精细的结构。
ISS结果通过将scRNA-seq结果与相应空间标记基因的结果进行比较。心脏神经嵴细胞仅在早期出现,而雪旺祖细胞仅在后期出现。心脏神经嵴细胞在任何时间点均不存在于房室结下心外膜间质中,但雪旺祖细胞在后期填充该区域。最后,该研究团队提供了一个公开的网络资源,以直观地探索调控人类心脏发育的空间基因表达模式(https://hdca-sweden.scilielab.se/a-study-on-human-heart-development/)。
8.Cell:新研究表明TOP1抑制疗法可阻止新冠病毒诱导的致命炎症
doi:10.1016/j.cell.2021.03.051
目前,由SARS-CoV-2冠状病毒引起的COVID-19大流行正在影响全球数百万人的生命,并对全球卫生系统和经济造成巨大负担。开发抗SARS-CoV-2的新疗法仍然是当务之急。在评估和分发预防措施的同时,迫切需要开发靶向SARS-CoV-2和具有治疗作用的药物,特别是针对COVID-19重症病例。大型回顾性研究表明,炎性细胞因子和促炎因子水平的升高与疾病严重程度和死亡率的增加有关。
减少感染时基因表达的诱导程度可能是开发针对与过度炎症相关的感染的新疗法的关键。为了了解SARS-CoV-2在感染过程中如何改变染色质功能和基因活性,在一项新的研究中,来自美国西奈山伊坎医学院等研究机构的研究人员在感染过程中进行了结构和表观遗传学的结合分析。相关研究结果于2021年3月30日在线发表在Cell期刊上,论文标题为“TOP1 inhibition therapy protects against SARS-CoV-2-induced lethal inflammation”。
这些作者对表达人ACE2受体的A549细胞(下称A549-ACE2细胞)在感染SARS-CoV-2后的早期(8h)和晚期(24h)以及在未感染时进行Hi-C分析,结果发现随着感染的发展,细胞基因组的大部分改变它们的全局性相互作用图谱,最终在感染后的24h时间点上与活性(A)或非活性(B)区室相关的染色质发生较大的重新分配。他们还发现这种感染激活的宿主基因大多数是炎症性的。
他们随后发现拓扑异构酶I(TOP1)控制SARS-CoV-2诱导的基因表达反应。他们在A549-ACE2细胞中进行siRNA介导的TOP1敲降,TOP1敲降后的细胞对这种病毒表现出明显的转录反应,从而导致很多感染诱导的基因遭受选择性抑制。对TOP1敲降后下调的基因进行分析表明其中的很多基因参与炎症反应。进一步的实验表明剔除TOP1降低炎症基因IL-6、CXCL2、CXCL3、CXCL8、EGR1和TNFAIP3的表达。此外,利用一种获得美国食品药品管理局(FDA)批准的TOP1抑制剂---拓扑替康(topotecan, TPT)---处理感染SARS-CoV-2的A549-ACE2细胞,结果发现与利用siRNA进行TOP1敲降一样,TPT处理抑制IL-6、CXCL2、CXCL3、CXCL8、EGR1和TNFAIP3表达。不过与具有抗病毒活性的瑞德西韦不同的是,TPT并不抑制病毒复制,这表明它的活性在于抑制宿主基因表达。
接着,这些作者在叙利亚金黄地鼠感染SARS-CoV-2后第一天和第二天,分别用TPT(10mg/kg)和二甲基亚砜(DMSO,作为对照)处理这些地鼠。在感染后第4天和第6天对来自这些地鼠的肺部进行组织学和转录组分析。他们发现TPT抑制受感染地鼠肺部中的炎症基因表达,而且接受TPT处理的受感染地鼠肺部的基因表达谱类似于未受感染地鼠肺部。不同于二甲基亚砜处理的那样,TPT处理减少受感染地鼠中肺部损伤的病理特征,而且感染后第4天和第6天,它们的肺部没有明显的肺泡腔浸润、渗出或出血。此外,当将TPT剂量下降5倍至2mg/kg时,在SARS-CoV-2感染期间,TPT处理仍然能有效地抑制受感染地鼠中的炎症基因表达,缓解炎症诱导的病理特征。这一结果支持以下假设:TPT在体内抑制SARS-CoV-2诱导的肺部炎症。
为了测试抑制炎症是否会给感染SARS-CoV-2的K18-hACE2小鼠提供保护效果,这些作者开展三种不同的TPT处理方案:早期方案,在感染后第一天和第二天给送2mg/kg TPT;中期方案,在感染后第三天和第四天给送2mg/kg TPT;晚期方案,感染后第四天和第五天给送2mg/kg TPT。他们的结果表明早期方案和中期方案不能有效地降低SARS-CoV-2 感染引起的发病率和死亡率,尽管中期方案显著地延迟体重减轻的发生。而晚期方案给受感染小鼠提供显著的生存获益,而且显著改善受感染小鼠的发病率。正如预期的那样,TPT处理与受感染小鼠肺部的炎症基因表达遭受抑制相关。
他们在受感染的K18-hACE2小鼠中评估了TPT处理的长期影响。相比于DMSO处理的小鼠,TPT处理的小鼠在感染后存活了9周。DMSO处理的小鼠和TPT处理的小鼠在感染后5周具有类似的中和抗体活性,这表明TPT处理并不会负面地影响适应性免疫反应。这表明TPT处理抑制这些受感染小鼠的高炎症反应可以使其摆脱SARS-CoV-2的致命感染。
9.重大突破!Cell论文指出仅添加7个基因就可让世界上基因组最小的合成细胞正常分裂和生长
doi:10.1016/j.cell.2021.03.008
5年前,科学家们高调地宣布,他们已经设计出一种精简的微生物细胞,该细胞能够在比任何已知有机体含有更少基因的情形下存活下来。但是这种“基因组最小细胞”常常会出现异常分裂。如今,在一项新的研究中,来自美国国家标准与技术研究院和克雷格-文特尔研究所(J. Craig Venter Institute, JCVI)等研究机构的研究人员通过仅放回7个基因,成功地对这种精简的微生物细胞进行校正,使之像天然的细胞一样生长。相关研究结果于2021年3月29日在线发表在Cell期刊上,论文标题为“Genetic requirements for cell division in a genomically minimal cell”。论文通讯作者为美国国家标准与技术研究院的合成生物学家Elizabeth Strychalski和克雷格-文特尔研究所的John I. Glass。
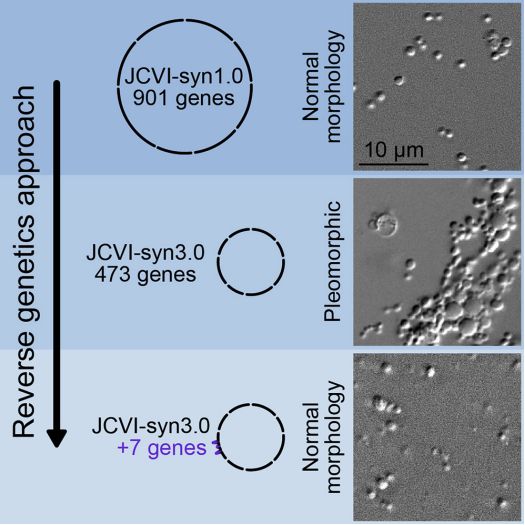
基因组最小的合成细胞发展历程,图片来自Cell, 2021, doi:10.1016/j.cell.2021.03.008。
但是这种JCVI-syn3.0细胞也有一种异常现象:它的许多后代都是畸形的。在这项新的研究中,为了检查实验室的条件是否可能给这些脆弱的合成细胞带来压力,Strychalski、Glass及其团队将这些合成细胞装在微流控芯片的腔室中。这些配置良好的腔室保护这些合成细胞免受营养培养基中的液体流动可能造成的伤害,并让他们观察细胞分裂的过程。
通过添加回不同的基因组合来确定所产生的细胞是否正常分裂,这些作者将所需的基因数量缩小到19个,然后进一步缩小。在这项新的研究中,他们发现,他们只需在JCVI-syn3.0中加入7个基因就可以恢复正常的细胞分裂。这7个基因分别是两个已知的细胞分裂基因(ftsZ和sepF)、一个作用底物未知的水解酶和4个编码功能未知的膜相关蛋白的基因。添加这7个基因可让JCVI-syn3.0合成细胞的表型类似于JCVI-syn1.0。
10.Cell: 研究揭示SARS-CoV-2英国突变株B.1.1.7在美国境内的起源与传播规律
doi:10.1016/j.cell.2021.03.052
自COVID-19疫情发生至今,已经有多种新型的变异毒株被发现,它们表现出比原始毒株更强的传播力度。其中,一种名为 “501 Y. V1; B.1.1.7” 的毒株携带N501Y突变,该毒株最早于2020年秋季在英国境内出现,之后传播至多个欧洲国家。无独有偶,南非以及巴西境内也鉴定出带有N501Y突变的变异毒株,分别为 “501Y.V2; B.1.351” 以及 “501Y.V3; P.1” 。然而,来自英国境内的B.1.1.7变异毒株刺突蛋白同时存在其它一些突变标志,其中包括69-70,144位点的氨基酸缺失以及A570D, P681H, T716I, S983A以及D1118H。
研究表明,B.1.1.7毒株具有比原始毒株更强的传播能力,其相比其它毒株的生长速率也要高40%-70%。虽然B.1.1.7毒株的确切源头至今仍然不清楚,但英国境内大规模的基因组学分析结果表明其更强的传播力与N501Y突变之间存在联系。
在最近发表于《Cell》杂志上的一项研究中,来自美国Scripps研究所的Kristian G. Andersen博士等人对B.1.1.7毒株在美国境内的流行趋势与传播动态特征进行了详尽的分析,希望能够对全球疫情的防控以及新型抗病毒疗法的开发提供思路。由于69-70氨基酸缺失突变会导致在相关检测中呈现阴性结果(被称为S gene target failure,SGTF),对此,研究者们对一年以来收集得到的患者样本进行了常规检测以及SGTF检测,试图寻找B.7.1.1突变毒株在美国境内的起源与流行趋势。
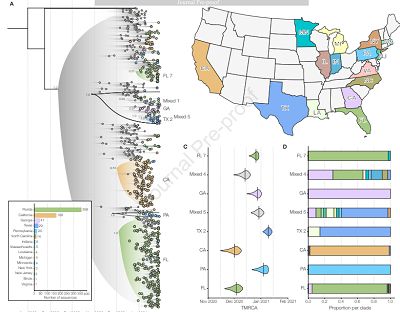
聚类分析揭示B.1.1.7变异毒株在美国境内的起源与传播趋势,图片来自Cell, 2021, doi:10.1016/j.cell.2021.03.052。
之后,作者比较了B.1.1. 7毒株与其它毒株在美国境内的传播速率。结果显示,B.1.1.7在全美境内的对数生长率为7.5%/天,以5.5天的间隔计算,转换之后的传播率为41%。 基于上述结果,作者认为如果B.1.1.7在美国境内继续保持上述传播速率,将在不久之后成为最主流的流行毒株。
为了探究B.1.1.7何时传入美国境内,作者将662份测序样本与292份境外测序样本合并进行贝叶斯运算。结果显示,大部分美国境内的B.1.1.7毒株序列可以分为两个类群,分别起源于加利福尼亚与佛罗里达。其中最早传入美国境内的毒株起源于加州,时间约为2020年12月1日。在接下来的几个月中又分别从佛州,佐治亚,宾州,纽约州等地相继传入。通过分析不同地区的B.1.1.7毒株数量与时间的关系,作者认为该毒株早在2020年底就已经在全美境内多地区扩散。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


