单抗药物全新临床研发进展
- alirocumab
- belimumab
- Benlysta
- brolucizumab
- cemiplimab
- eptinezumab
- inebilizumab
- ixekizumab
- Libtayo
- PD-1
- PD-L1
- Praluent
- ravulizumab
- risankizumab
- Skyrizi
- Taltz
- Ultomiris
- 单抗药物
- 派姆单抗
来源:本站原创 2019-04-30 20:01
2019年4月30日讯/生物谷BIOON/---抗体是由B细胞转化而来的浆细胞分泌的,每个B细胞株只能产生一种它专有的、针对一种特异性抗原决定簇的抗体。这种从一株单一细胞系产生的抗体就叫单克隆抗体(McAb),简称单抗。第一代单抗来自于Koehler和Milstein于1975年开发出的杂交瘤(hybridoma)抗体技术:在细胞融合技术的基础上,将能够分泌特异性抗体的小鼠致敏B细胞和具有无限繁殖
2019年4月30日讯/生物谷BIOON/---抗体是由B细胞转化而来的浆细胞分泌的,每个B细胞株只能产生一种它专有的、针对一种特异性抗原决定簇的抗体。这种从一株单一细胞系产生的抗体就叫单克隆抗体(McAb),简称单抗。第一代单抗来自于Koehler和Milstein于1975年开发出的杂交瘤(hybridoma)抗体技术:在细胞融合技术的基础上,将能够分泌特异性抗体的小鼠致敏B细胞和具有无限繁殖能力的小鼠骨髓瘤细胞融合为B细胞杂交瘤,用具备这种特性的单个杂交瘤细胞培养成细胞群,可制备针对一种抗原表位的特异性抗体,即单克隆抗体(monoclonal antibody,Mab),简称单抗,如图1所示。但是,人体免疫系统能够识别鼠源性单抗,会引起人抗鼠抗体反应(HAMA),这不仅让治疗性单抗药物半衰期变短,疗效减弱,有时还会引起严重的不良反应,因此第一代单抗的临床应用受到了很大限制。
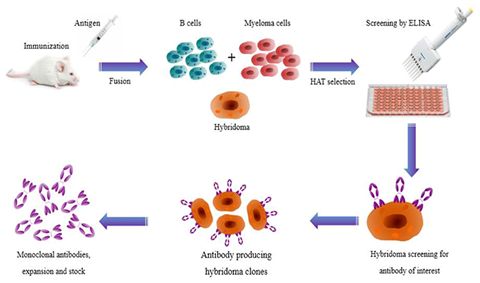
自从1986年全球第一个鼠源性单抗药物Muromonab OKT3问世,全球已近有80个单抗药物上市。迄今为止,单抗药物已经发展到了第四代:第一代为鼠源单抗(momab),第二代为人鼠嵌合型单抗(ximab),第三代为人源化单抗(zumab),第四代为全人源化单抗(mumab)。人源化单抗和全人源化单抗的优势在于可以克服人抗鼠抗体反应,可避免单抗分子被免疫系统当作异源蛋白而被快速清除,提高单抗分子的生物学活性。特别地,全人源化单抗的可变区和恒定区都是人源的,可在人源化单抗的基础上进一步去除免疫原性和毒副作用。人源化单抗药物和全人源化单抗药物具有高亲和力、高特异性以及毒副作用小的特点,极大地克服了鼠源单抗和人鼠嵌合型单抗药物的各种缺点,因而已经成为了治疗性抗体药物发展的必然趋势。
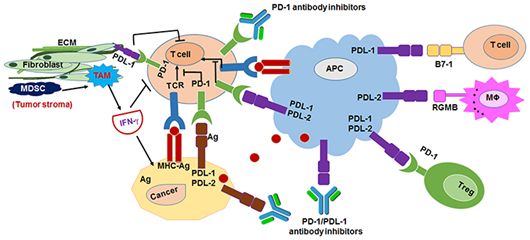
单抗药物作用的靶点通常为细胞表面的疾病相关抗原或特定的受体,比如位于肿瘤细胞表面上的受体PD-1和位于T细胞表面上的配体PD-L1。在单抗药物中,风头正劲的PD-1/PD-L1抑制剂就属于单抗药物,是近年来肿瘤免疫疗法研究的热点。已上市的纳武单抗和派姆单抗属于PD-1抑制剂,主要用于黑素瘤和非小细胞肺癌的治疗,对肾细胞癌、膀胱癌、霍奇金淋巴瘤等的疗效还在大规模临床试验中。PD-L1抑制剂阿替珠单抗(atezolizumab,商品为Tecentriq)、度伐单抗(durvalumab,商品名为Imfinzi)和阿维单抗(avelumab,商品名Bavencio)已被批准用于治疗尿道上皮癌,还有其他几种药物尚处于早期临床试验阶段。2018年9月28日,FDA批准了由赛诺菲(Sanofi)和再生元(Regeneron)联合研发的Libtayo(cemiplimab-rwlc)上市,用于治疗转移性皮肤鳞状细胞癌(CSCC)或不能接受治愈性手术或放疗的局部晚期CSCC患者。这也是由FDA批准获批上市的第3款抗PD-1抗体。
截至目前,单抗药物已经成为生物医药的重要组成部分,在医药治疗上也具有广阔的应用前景,已经被成功用于治疗肿瘤、自身免疫性疾病、感染性疾病和移植排斥反应等多种疾病。基于此,让我们梳理一下单抗药物临床研究方面最新取得的进展,以飨读者。
1.新型降脂药Praluent获批新适应症,用于降低心血管疾病成人患者的心血管病风险
2019年4月26日,法国制药巨头赛诺菲(Sanofi)与合作伙伴再生元(Regeneron)宣布,美国食品和药物管理局(FDA)已批准PCSK9抑制剂类降脂药Praluent(alirocumab)一个新的适应症:用于患有心血管疾病的成人患者,降低心脏病发作、中风、需要住院治疗的不稳定性心绞痛的风险。高水平的低密度脂蛋白胆固醇(LDL-C)会增加患者发生严重心血管事件的风险,如心脏病发作或中风。经历过心脏病发作或中风的成年人中,再次发生心血管事件的风险显著升高。
此外,FDA还批准Praluent作为单药或联用其他降脂疗法(如他汀类、依泽替米贝),辅助饮食调整,用于治疗患有原发性高脂血症(包括杂合子家族性高胆固醇血症)的成人患者,以降低LDL-C。
Praluent是一种重组人IgG1单克隆抗体,靶向一种名为前蛋白转化酶枯草溶菌素9型(PCSK9)的蛋白,该蛋白可降低肝脏从血液中清除低密度脂蛋白胆固醇(LDL-C)的能力,而LDL-C被公认为心血管疾病(CVD)的主要风险因子。PCSK9抑制剂提供了一种全新的治疗模式来对抗LDL-C,被视为他汀类之后降脂领域取得的最大进步。
此次新适应症批准,是基于评估Praluent心血管预后的大规模、里程碑III期临床研究ODYSSEY OUTCOMES的结果。该研究(n=18924)在入组研究前的1-12个月内(中位时间2.6个月)发生了一次急性冠脉综合征(ACS)并且已经在接受最大剂量他汀类药物治疗的患者中开展,评估了添加Praluent至最大耐受剂量他汀类药物对心血管结局的影响。
结果显示,在短期内发生了一次ACS(如心脏病发作)事件的患者中,与安慰剂相比,Praluent显著降低了MACE风险。具体数据为,Praluent治疗组:(1)主要心血管事件风险显著降低15%(HR=0.85,CI:0.78-0.93,p=0.0003),主要终点包括首次心脏病发作、中风、冠心病(CHD)死亡、需住院治疗的不稳定性心绞痛。(2)中风风险降低27%、非致命性心脏病发作风险降低14%、需住院治疗的不稳定性心绞痛风险降低39%。(3)全因死亡风险降低15%(HR=0.85,CI:0.73-0.98,名义p=0.026)。
除了注射部位反应(Praluent 3.8%,安慰剂2.1%)之外,Praluent组合安慰剂组不良反应相似。在这项ODYSSEY OUTCOMES临床研究中,发生在5%以上患者中的不良事件包括:非心脏性胸痛(Praluent 7.0%,安慰剂6.8%)、鼻咽炎(Praluent 6.0%,安慰剂5.6%)、肌痛(Praluent 5.6%,安慰剂5.3%)。
2.长效C5补体抑制剂Ultomiris欧盟即将获批,治疗阵发性睡眠性血红蛋白尿症(PNH)
2019年4月26日,作为一家致力于罕见病新药研发的美国制药公司,Alexion宣布欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布积极审查意见,推荐批准Ultomiris(ravulizumab),该药是第一种也是唯一一种每8周给药一次的长效C5补体抑制剂,用于治疗阵发性睡眠性血红蛋白尿症(PNH)成人患者。现在,CHMP的意见将递交至欧盟委员会,后者将参考CHMP的意见并在未来2-3个月做出最终审查决定。
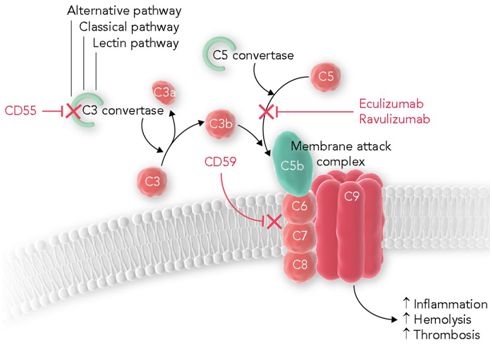
Ravulizumab是一种以补体C5为靶点的人源化单抗,能抑制人体免疫系统补体级联反应中的C5蛋白。在美国,Ultomiris于2018年12月获得FDA批准,用于PNH成人患者的治疗。目前,Ultomiris治疗PNH成人患者的上市申请也正在接受日本监管机构的审查。在美国和欧盟,Ultomiris均被授予了治疗PNH的孤儿药资格。
CHMP推荐批准Ultomiris,是基于2项关键性III期临床研究的综合数据,这是有史以来在PNH患者中开展的最大规模的III期研究,共入组了441例患者,包括从未接受过补体抑制剂治疗的(初治)PNH患者,以及接受Soliris(eculizumab)病情稳定的PNH患者。数据显示,Ultomiris每8周输注一次与Soliris每2周输注一次在全部11个终点(主要终点和全部关键次要终点)方面均达到了非劣效性。研究中,Ultomiris的安全性与Soliris的安全性相似。最近公布的额外数据表明,Ultomiris提供了持续8周的即刻和完全的C5抑制,同时消除了与不完全的C5抑制相关的突破性溶血。Ultomiris迄今为止的整个临床开发项目代表了超过750多患者年的经验。
Ultomiris被定位为Alexion公司重磅药物Soliris的升级版,后者于2007年首次获准上市,已获批治疗3种罕见病,分别为PNH、非典型溶血性尿毒综合征(aHUS)、抗乙酰胆碱受体抗体阳性全身型重症肌无力(gMG)。此外,Soliris治疗脊髓炎-视神经频谱障碍(NMOSD)于今年2月底在美国监管方面进入FDA的优先审查。
3.肿瘤免疫治疗药物Libtayo获欧盟CHMP推荐批准用于治疗晚期皮肤鳞状细胞癌
2019年4月26日,法国制药巨头赛诺菲(Sanofi)与合作伙伴再生元(Regeneron)宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布积极审查意见,推荐有条件批准PD-1肿瘤免疫治疗药物Libtayo(cemiplimab),用于不适合根治性手术或根治性放疗的转移性或局部晚期皮肤鳞状细胞癌(CSCC)成人患者的治疗。现在,CHMP的意见将递交至欧盟委员会,后者将参考CHMP的意见并在未来2-3个月做出最终审查决定。
CHMP推荐批准Libtayo,是基于开放标签、多中心、非随机II期研究EMPOWER-CSCC-1(Study 1540)以及来自I期研究(Study 1423)2个晚期CSCC扩展队列的汇总分析数据。此次分析共纳入了75例转移性CSCC患者和33例局部晚期CSCC患者。数据显示,Libtayo治疗确认的客观缓解率为47%(95%CI:38-57),其中完全缓解率为4%,所有完全缓解均发生在转移性CSCC患者中。在最后一次评估时,有些患者持续缓解时间超过15个月,有61%的患者缓解持续至少6个月。安全性方面,最常见的不良反应包括:疲劳、皮疹和腹泻。
作为有条件批准的一部分,赛诺菲和再生元需要提供来自EMPOWER-CSCC-1研究的额外数据,包括一个新加入的试验组的结果,以进一步确认Libtayo的利益风险状况。
CSCC是一种常见的皮肤癌症,在欧盟尚无批准治疗晚期CSS的药物。如果获得批准,Libtayo将成为欧盟首个也为唯一一个被批准用于晚期CSCC患者的治疗药物。在美国,Libtayo于2018年9月获FDA批准,成为美国市场中首个获批治疗晚期CSCC的药物。
4.默沙东Keytruda(可瑞达)治疗PD-L1阳性胃癌关键性III期临床失败
2019年4月25日,肿瘤免疫治疗巨头默沙东(Merck & Co)公布了PD-1肿瘤免疫疗法Keytruda(可瑞达,通用名:pembrolizumab,派姆单抗)治疗胃癌关键III期研究KEYNOTE-062最终分析得出的顶线结果。该研究评估了Keytruda作为单药以及联合化疗(顺铂与5-氟尿嘧啶或与卡培他滨)一线治疗晚期胃或胃食管交界腺癌。
结果显示,在研究的单药治疗组中,Keytruda达到了一个主要终点:在整个PD-L1阳性(合并阳性评分[CPS]≥1)意向性治疗(ITT)患者群体中,与标准护理化疗在总生存期(OS)方面表现出非劣效性。然而,在联合治疗组中,与化疗相比,Keytruda联合化疗在OS(CPS≥1或CPS≥10)或无进展生存期(PFS)(CPS≥1)方面没有显示出优越性。该研究中,Keytruda的安全性与此前在胃癌研究中观察到的安全性一致。研究结果将在2019年6月2日在芝加哥举行的美国临床肿瘤学会(ASCO)第55届年会上发布,并将与监管机构讨论。
默沙东研究实验室首席医疗官、高级副总裁兼全球临床开发负责人Roy Baynes博士表示,“胃癌历来难以治疗,不幸的是,在许多国家胃癌仍然与高死亡率有关,尤其是在转移阶段。尽管这项研究并没有达到所有的主要终点,但Keytruda单药疗法确实显示了在整个患者群体中的非劣效总生存期。我们衷心感谢参与这这项研究的患者和研究人员,并期待与医疗界分享详细的研究结果。”
2017年9月,美国FDA加速批准Keytruda作为三线治疗方案,用于既往已接受2种或多种疗法(包括含氟嘧啶和含铂化疗,HER2/neu靶向疗法[如果适合的话])治疗但病情进展、肿瘤表达PD-L1(CPS≥1)的复发性局部晚期或转移性胃癌或胃食管交界癌患者。
KEYNOTE-062研究是用于这一加速三线批准的潜在验证性试验。除了KEYNOTE-062之外,默沙东胃癌项目中还包括一线治疗III期研究KEYNOTE-811和KEYNOTE-859,以及新辅助和辅助治疗研究KEYNOTE-585。
5.葛兰素史克单抗药物Benlysta获美国FDA批准用于儿童系统性红斑狼疮
2019年4月26日,英国制药巨头葛兰素史克(GSK)宣布,美国FDA通过优先审查已批准狼疮药物Benlysta用于5岁及以上系统性红斑狼疮(SLE)儿童患者。值得一提的是,Benlysta是第一种在美国市场获批用于治疗SLE儿童患者的药物。
Benlysta的活性成分为belimumab(贝利木单抗),是一种人源IgG1γ单抗,可特异性结合可溶性B细胞刺激因子(BLyS),阻止BLyS与B细胞结合,促进B细胞凋亡,从而治疗SLE。
此次批准,是基于上市后承诺研究(PLUTO研究)的数据。该研究评估了10 mg/kg剂量Benlysta联合标准疗法相对于安慰剂联合标准疗法治疗5-11岁(n=13)、12-17岁(n=80)SLE儿童患者治疗一年的疗效、安全性和药代动力学。
根据系统性红斑狼疮反应指数(SRI)反应率评估,接受Benlysta联合标准治疗(52.8%)的患者与接受安慰剂联合标准治疗(43.6%)的患者相比,在52周时获得有临床意义疾病活动改善的儿童比例在数值上更高。经历一次以上不良事件(AE)和一次严重不良事件(SAE)的患者比例方面,Benlysta治疗组分别为79.2%和17.0%,安慰剂组分别为82.5%和35.0%。导致停药的不良事件包括狼疮性肾炎、甲型肝炎、高转氨酶血症、急性胰腺炎、疱疹后神经痛、视网膜血管炎和胰腺炎。
Benlytsa是近50多年来获批治疗SLE的首个新药,该药有2种剂型。2011年,静脉注射剂型(IV)Benlysta获批用于治疗自身抗体阳性的SLE成人患者,该药每4周输注一次,剂量根据体重调整(10mg/kg),耗时约1个小时。2017年7月,皮下注射剂型(SC)Benlysta获批,用于正在接受标准治疗的活动性、自身抗体阳性SLE成人患者,此次批准,也标志着治疗SLE的首个皮下注射药物获批,患者通过培训后可自行皮下注射给药,该剂型将为SLE患者群体提供一种重要的治疗选择。
6.新型抗炎药Skyrizi获美国FDA批准治疗中度至重度斑块型银屑病
2019年4月23日,生物技术巨头艾伯维(AbbVie)宣布,美国FDA已批准Skyrizi(risankizumab-rzaa),用于适合系统疗法或光疗的中度至重度斑块型银屑病成人患者的治疗。在临床试验中,Skyrizi具有很高的、持久的皮肤斑块清除率——大部分患者(82%和81%)接受Skyrizi治疗一年后达到90%皮肤斑块清除(PASI90),多数患者(56%和60%)达到完全皮肤斑块清除(PASI100)。
Skyrizi的活性药物成分为risankizumab,这是一种单克隆抗体药物,通过特异性靶向IL-23p19亚基选择性阻断体内免疫炎性介质白细胞介素-23(IL-23),IL-23是一种细胞因子,被认为在许多慢性免疫性疾病中起着关键作用。
艾伯维公司表示,Skyrizi预计将在5月初在美国上市。该药通过皮下注射给药,推荐剂量为150mg(2针,75mg/针),在第0、4周分别用药一次,之后每3个月(12周)用药一次。Skyrizi可在医院注射,也可经培训后自我注射。
此次批准,是基于4项随机、安慰剂和/或阳性药物对照、关键性III期临床研究(ultIMMa-1、ultIMMa-2、IMMvent、IMMhance)的数据。这些研究共入组了2000多例中度至重度斑块型银屑病成人患者。结果显示,Skyrizi治疗仅仅16周后就显著改善了皮肤银屑病斑块清除,并在治疗一年内(52周)维持了斑块清除。
值得一提的是,此次批准,也标志着Skyrizi赢得的全球第3个监管批准。今年3月底,Skyrizi获日本批准,用于对常规疗法反应不足的斑块型银屑病、泛发性脓疱型银屑病(GPP)、红皮病型银屑病、银屑病关节炎成人患者的治疗。上周,Skyrizi获加拿大批准,用于适合系统疗法或光疗的中度至重度斑块型银屑病成人患者的治疗。目前,Skyrizi也正在接受欧盟的监管审查。今年3月初,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)推荐批准Skyrizi用于适合系统疗法的中度至重度斑块型银屑病成人患者,欧盟委员会预计在今年上半年做出审查决定。
7.第4款CGRP靶向偏头痛抗体疗法eptinezumab在美国进入审查
2019年4月22日,作为一家专注于开发新型抗体疗法用于治疗偏头痛的生物制药公司,Alder BioPharmaceuticals宣布,美国FDA已受理eptinezumab预防偏头痛的生物制品许可申请(BLA)。如果获得批准,eptinezumab将成为预防偏头痛的首个每季度一次的静脉输液疗法。
该药BLA的提交,是基于2项III期研究PROMISE 1(NCT02559895)和PROMISE 2(NCT02974153)的数据。这2项研究分别评估了eptinezumab治疗发作性偏头痛(n=888)和慢性偏头痛(n=1072)的疗效和安全性,数据显示,均达到了全部主要终点和关键次要终点。研究中,eptinezumab安全性和耐受性与安慰剂相似。
eptinezumab是一种人源化IgG1单克隆抗体,靶向结合降钙素相关基因肽(CGRP)。CGRP是一种神经肽,已被证明在偏头痛发作时释放,可能是偏头痛发作的诱因。目前,CGRP已成为偏头痛药物研发的热门靶点。
用药方面,eptinezumab每3个月一次静脉输注,Aimovig和Emgality均为每月一次皮下注射,Ajovy则可每月一次或每3个月一次皮下注射。
截至目前,已有3款以CGRP及其受体为靶点的单抗类偏头痛疗法上市,分别为安进和诺华的Aimovig(靶向CGRP受体)、梯瓦的Ajovy(靶向CGRP)、礼来的Emgality(靶向CGRP)。
8.单抗药物inebilizumab治疗神经脊髓炎频谱障碍获美FDA突破性药物资格
2019年4月18日,Viela Bio公司宣布,美国FDA已授予抗CD19单抗inebilizumab(以前称MEDI-551)治疗视神经脊髓炎频谱障碍(NMOSD)的突破性药物资格(BTD)。此前,FDA和欧洲药品管理局(EMA)分别于2016年3月和2017年3月授予了inebilizumab治疗NMOSD的孤儿药资格。
FDA授予inebilizumab BTD,是基于关键性N-MOmentum研究的数据。该研究是一项随机、双模拟、安慰剂对照研究,共入组了231例NMOSD患者,包括存在或不存在AQP4-IgG抗体的患者。研究中,患者随机分为2组,分别接受2次静脉注射inebilizumab单药疗法或安慰剂,并随访6.5个月。之后,患者进入开放标签扩展期,所有患者每6个月一次接受一次inebilizumab治疗。主要终点是从治疗开始到NMOSD发作的时间。
结果显示,该研究达到了主要终点和关键次要终点:与安慰剂组相比,inebilizumab治疗组经历一次NMOSD发作的风险显著降低了77%。此外,与安慰剂组相比,inebilizumab治疗组残疾恶化显著降低。该研究中,inebilizumab具有良好的安全性和可接受的耐受性。
inebilizumab是一种人源化单抗,与CD19具有很高的亲和力,CD19是一种广泛表达于B细胞的蛋白质,包括分泌抗体的浆母细胞和一些浆细胞。inebilizumab与CD19结合后,这些细胞迅速从循环系统中耗竭。
9.抗炎药Taltz治疗放射学阴性中轴型脊柱关节炎III期研究获得成功
2019年4月22日,美国制药巨头礼来(Eli Lilly)宣布,评估抗炎药Taltz(ixekizumab)治疗放射学阴性中轴型脊柱关节炎(nr-axSpA)的III期临床研究COAST-X达到了主要终点和全部次要终点。这些结果为Taltz治疗nr-axSpA患者治疗中的潜在作用提供了临床证据。
COAST-X是一项多中心、随机、双盲、安慰剂对照、52周研究,评估了Taltz在既往未接受生物类疾病修饰抗风湿药物(bDMARD,初治)的nr-axSpA患者中的疗效和安全性。研究的主要终点是国际脊柱关节炎学会评估改善40%(ASAS40)。
结果显示,根据达到ASAS40缓解的患者比例评价,与安慰剂相比,Taltz在第16周和第52周均达到了主要终点,显示nr-axSpA症状和体征具有统计学意义的显著改善。此外,Taltz在第16周和第52周也达到了主要的次要终点,包括:强直性脊柱炎活动度评分(ASDAS)显著改善、巴斯强直性脊柱炎活动度评分(BASDAI)的显著改善、达到低疾病活动(ASDAS<2.1)的患者比例、骶髂关节炎显著改善(第16周,采用MRI评价)、36项短期健康调查(SF-36)躯体健康总评(PCS)评分的显著改善。该研究中,Taltz的安全概况与之前报告III期研究中一致,未检测到新的安全信号。
Taltz的活性药物成分为ixekizumab,这是一种单克隆抗体,针对具有促炎作用的细胞因子白介素-17A(IL-17A)具有较高的亲和力和特异性,可抑制IL-17A与IL-17受体的结合。ixekizumab不会与细胞因子IL-17B、IL-17C、IL-17D、IL-17E或IL-17F结合。IL-17A是一种天然存在的细胞因子,参与正常的炎症和免疫反应。对于银屑病患者而言,IL-17A在驱动角化细胞(皮肤细胞)过度增殖和活化方面发挥了重要作用。
Taltz通过皮下注射给药,在美国市场,该药于2016年3月首次获批,成为继诺华重磅抗炎药Cosentyx(secukinumab)之后美国上市的第2款IL-17A单抗药物。目前,Taltz已获批的适应症包括:(1)治疗活动性银屑病关节炎(PsA)成人患者;(2)治疗适合系统疗法或光疗的中度至重度斑块型银屑病成人患者。
10.诺华brolucizumab治疗湿性AMD在美国进入优先审查
2019年4月15日,瑞士制药巨头诺华(Novartis)宣布,美国FDA已受理新一代眼科药物brolucizumab(RTH258)治疗湿性年龄相关性黄斑变性(wet-AMD,又名新生血管性AMD,nAMD)的生物制品许可申请(BLA)。值得一提的是,诺华使用了一张优先审评券(PRV)来加速该BLA审查,将把审查周期由常规的10个月缩短至6个月。如果获得批准,诺华预计将在2019年将brolucizumab推向市场。
此次BLA,主要基于III期HAWK研究(NCT02307682)和HARRIER研究(NCT02434328)的数据。这2项研究均为前瞻性、随机、双盲、多中心研究,在wet-AMD患者中开展,评估了brolucizumab相对于再生元重磅眼科产品Eylea(aflibercept,阿柏西普)的疗效和安全性。
结果显示,2项研究均达到了主要终点,在治疗第48周,brolucizumab(6mg)在改善视力方面疗效非劣效于Eylea,具体数据为:HAWK研究和HARRIER研究中,brolucizumab(6mg)治疗组最佳矫正视力(BCVA)相对基线的平均变化分别为6.6个字母(Eylea治疗组为6.8个字母)和6.9个字母(Eylea治疗组为7.6个字母)。
此外,brolucizumab(6mg)在疾病进展关键指标的3个次要终点方面也表现出优势:疾病活动度、中央视野视网膜厚度、视网膜液(视网膜内液和/或视网膜下液)。具体数据为:(1)在治疗第48周,与Eylea治疗组相比,brolucizumab(6mg)治疗组疾病活动的患者比例更低(HAWK研究:23.5% vs 33.5%,p=0.0022;HARRIER研究:21.9% vs 31.4%,p=0.0022);(2)在治疗第48周,与Eylea治疗组相比,brolucizumab(6mg)治疗组视网膜液关键标志物显著减少:存在视网膜内液(IRF)和/或视网膜下液(SRF)的患者比例方面,HAWK研究中减少31%(p<0.0001)、HARRIER研究中减少26%(p<0.0001)。
值得一提的是,HAWK研究和HARRIER研究是在wet-AMD患者中前瞻性地证实brolucizumab以每12周一次(3个月一次)给药方案启动治疗表现出显著疗效的首批也是唯一一批全球性头对头临床研究。

brolucizumab(RTH258)是一种~26 kDa的人源化单链抗体可变区片段(scfv),针对血管内皮生长因子-A(VEGF-A)的所有亚型均有很强的抑制作用,并具有很高的亲和力。在临床前研究中,brolucizumab通过阻断配体-受体相互作用来抑制VEGF受体的激活。增加的VEGF途径信号与病理性眼部血管生成和视网膜水肿有关。在脉络膜视网膜血管疾病患者中,抑制VEGF途径可抑制新生血管病变的生长,缓解视网膜水肿,改善视力。
其实,制药公司和科学家们针对单抗药物的临床研究不胜枚举,以上罗列的仅是其中的一小部分。当然,其中的一些单抗药物虽然已开展人体临床试验,但是仍然停留在I期或II期临床试验阶段,参与临床试验的患者人数仍然偏少,仍需通过招募更多的患者人数来开展III期临床试验。随着科学家们在单抗药物制造技术方面不断取得新的突破,比如人杂交瘤技术、EB病毒(EBV)转化 B 淋巴细胞技术、噬菌体展示技术、转基因小鼠抗体制备技术和单个B细胞抗体制备技术等不断涌出,具有更好性能的第四代单抗药物越来越多涌现出来,从而有望为更多患者带来福音。在未来,科学家们将从病理学、分子生物学、基因、蛋白和组学等不同角度深入探究单抗药物在正常的生理过程和疾病发生的重要作用及其作用机理,人们最终有朝一日能够开发出更多更好的单抗药物,用于治疗癌症、炎症、肥胖、糖尿病、血液系统疾病、神经系统疾病和遗传疾病等一系列疾病。(生物谷 Bioon.com)

图1.杂交瘤抗体技术示意图,图片来自Frontiers in Microbiology, 2017, doi:10.3389/fmicb.2017.00495。
自从1986年全球第一个鼠源性单抗药物Muromonab OKT3问世,全球已近有80个单抗药物上市。迄今为止,单抗药物已经发展到了第四代:第一代为鼠源单抗(momab),第二代为人鼠嵌合型单抗(ximab),第三代为人源化单抗(zumab),第四代为全人源化单抗(mumab)。人源化单抗和全人源化单抗的优势在于可以克服人抗鼠抗体反应,可避免单抗分子被免疫系统当作异源蛋白而被快速清除,提高单抗分子的生物学活性。特别地,全人源化单抗的可变区和恒定区都是人源的,可在人源化单抗的基础上进一步去除免疫原性和毒副作用。人源化单抗药物和全人源化单抗药物具有高亲和力、高特异性以及毒副作用小的特点,极大地克服了鼠源单抗和人鼠嵌合型单抗药物的各种缺点,因而已经成为了治疗性抗体药物发展的必然趋势。
单抗药物作用的靶点通常为细胞表面的疾病相关抗原或特定的受体,比如位于肿瘤细胞表面上的受体PD-1和位于T细胞表面上的配体PD-L1。在单抗药物中,风头正劲的PD-1/PD-L1抑制剂就属于单抗药物,是近年来肿瘤免疫疗法研究的热点。已上市的纳武单抗和派姆单抗属于PD-1抑制剂,主要用于黑素瘤和非小细胞肺癌的治疗,对肾细胞癌、膀胱癌、霍奇金淋巴瘤等的疗效还在大规模临床试验中。PD-L1抑制剂阿替珠单抗(atezolizumab,商品为Tecentriq)、度伐单抗(durvalumab,商品名为Imfinzi)和阿维单抗(avelumab,商品名Bavencio)已被批准用于治疗尿道上皮癌,还有其他几种药物尚处于早期临床试验阶段。2018年9月28日,FDA批准了由赛诺菲(Sanofi)和再生元(Regeneron)联合研发的Libtayo(cemiplimab-rwlc)上市,用于治疗转移性皮肤鳞状细胞癌(CSCC)或不能接受治愈性手术或放疗的局部晚期CSCC患者。这也是由FDA批准获批上市的第3款抗PD-1抗体。

图2.PD-1/PD-L1抑制剂作用机制,图片来自Frontiers in Pharmacology,2017, doi:10.3389/fphar.2017.00561。
截至目前,单抗药物已经成为生物医药的重要组成部分,在医药治疗上也具有广阔的应用前景,已经被成功用于治疗肿瘤、自身免疫性疾病、感染性疾病和移植排斥反应等多种疾病。基于此,让我们梳理一下单抗药物临床研究方面最新取得的进展,以飨读者。
1.新型降脂药Praluent获批新适应症,用于降低心血管疾病成人患者的心血管病风险
2019年4月26日,法国制药巨头赛诺菲(Sanofi)与合作伙伴再生元(Regeneron)宣布,美国食品和药物管理局(FDA)已批准PCSK9抑制剂类降脂药Praluent(alirocumab)一个新的适应症:用于患有心血管疾病的成人患者,降低心脏病发作、中风、需要住院治疗的不稳定性心绞痛的风险。高水平的低密度脂蛋白胆固醇(LDL-C)会增加患者发生严重心血管事件的风险,如心脏病发作或中风。经历过心脏病发作或中风的成年人中,再次发生心血管事件的风险显著升高。
此外,FDA还批准Praluent作为单药或联用其他降脂疗法(如他汀类、依泽替米贝),辅助饮食调整,用于治疗患有原发性高脂血症(包括杂合子家族性高胆固醇血症)的成人患者,以降低LDL-C。
Praluent是一种重组人IgG1单克隆抗体,靶向一种名为前蛋白转化酶枯草溶菌素9型(PCSK9)的蛋白,该蛋白可降低肝脏从血液中清除低密度脂蛋白胆固醇(LDL-C)的能力,而LDL-C被公认为心血管疾病(CVD)的主要风险因子。PCSK9抑制剂提供了一种全新的治疗模式来对抗LDL-C,被视为他汀类之后降脂领域取得的最大进步。
此次新适应症批准,是基于评估Praluent心血管预后的大规模、里程碑III期临床研究ODYSSEY OUTCOMES的结果。该研究(n=18924)在入组研究前的1-12个月内(中位时间2.6个月)发生了一次急性冠脉综合征(ACS)并且已经在接受最大剂量他汀类药物治疗的患者中开展,评估了添加Praluent至最大耐受剂量他汀类药物对心血管结局的影响。
结果显示,在短期内发生了一次ACS(如心脏病发作)事件的患者中,与安慰剂相比,Praluent显著降低了MACE风险。具体数据为,Praluent治疗组:(1)主要心血管事件风险显著降低15%(HR=0.85,CI:0.78-0.93,p=0.0003),主要终点包括首次心脏病发作、中风、冠心病(CHD)死亡、需住院治疗的不稳定性心绞痛。(2)中风风险降低27%、非致命性心脏病发作风险降低14%、需住院治疗的不稳定性心绞痛风险降低39%。(3)全因死亡风险降低15%(HR=0.85,CI:0.73-0.98,名义p=0.026)。
除了注射部位反应(Praluent 3.8%,安慰剂2.1%)之外,Praluent组合安慰剂组不良反应相似。在这项ODYSSEY OUTCOMES临床研究中,发生在5%以上患者中的不良事件包括:非心脏性胸痛(Praluent 7.0%,安慰剂6.8%)、鼻咽炎(Praluent 6.0%,安慰剂5.6%)、肌痛(Praluent 5.6%,安慰剂5.3%)。
2.长效C5补体抑制剂Ultomiris欧盟即将获批,治疗阵发性睡眠性血红蛋白尿症(PNH)
2019年4月26日,作为一家致力于罕见病新药研发的美国制药公司,Alexion宣布欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布积极审查意见,推荐批准Ultomiris(ravulizumab),该药是第一种也是唯一一种每8周给药一次的长效C5补体抑制剂,用于治疗阵发性睡眠性血红蛋白尿症(PNH)成人患者。现在,CHMP的意见将递交至欧盟委员会,后者将参考CHMP的意见并在未来2-3个月做出最终审查决定。

图3.eculizumab和ravulizumab的补体调节和作用,图片来自Blood, 2019, doi:10.1182/blood-2018-12-891499。
Ravulizumab是一种以补体C5为靶点的人源化单抗,能抑制人体免疫系统补体级联反应中的C5蛋白。在美国,Ultomiris于2018年12月获得FDA批准,用于PNH成人患者的治疗。目前,Ultomiris治疗PNH成人患者的上市申请也正在接受日本监管机构的审查。在美国和欧盟,Ultomiris均被授予了治疗PNH的孤儿药资格。
CHMP推荐批准Ultomiris,是基于2项关键性III期临床研究的综合数据,这是有史以来在PNH患者中开展的最大规模的III期研究,共入组了441例患者,包括从未接受过补体抑制剂治疗的(初治)PNH患者,以及接受Soliris(eculizumab)病情稳定的PNH患者。数据显示,Ultomiris每8周输注一次与Soliris每2周输注一次在全部11个终点(主要终点和全部关键次要终点)方面均达到了非劣效性。研究中,Ultomiris的安全性与Soliris的安全性相似。最近公布的额外数据表明,Ultomiris提供了持续8周的即刻和完全的C5抑制,同时消除了与不完全的C5抑制相关的突破性溶血。Ultomiris迄今为止的整个临床开发项目代表了超过750多患者年的经验。
Ultomiris被定位为Alexion公司重磅药物Soliris的升级版,后者于2007年首次获准上市,已获批治疗3种罕见病,分别为PNH、非典型溶血性尿毒综合征(aHUS)、抗乙酰胆碱受体抗体阳性全身型重症肌无力(gMG)。此外,Soliris治疗脊髓炎-视神经频谱障碍(NMOSD)于今年2月底在美国监管方面进入FDA的优先审查。
3.肿瘤免疫治疗药物Libtayo获欧盟CHMP推荐批准用于治疗晚期皮肤鳞状细胞癌
2019年4月26日,法国制药巨头赛诺菲(Sanofi)与合作伙伴再生元(Regeneron)宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布积极审查意见,推荐有条件批准PD-1肿瘤免疫治疗药物Libtayo(cemiplimab),用于不适合根治性手术或根治性放疗的转移性或局部晚期皮肤鳞状细胞癌(CSCC)成人患者的治疗。现在,CHMP的意见将递交至欧盟委员会,后者将参考CHMP的意见并在未来2-3个月做出最终审查决定。
CHMP推荐批准Libtayo,是基于开放标签、多中心、非随机II期研究EMPOWER-CSCC-1(Study 1540)以及来自I期研究(Study 1423)2个晚期CSCC扩展队列的汇总分析数据。此次分析共纳入了75例转移性CSCC患者和33例局部晚期CSCC患者。数据显示,Libtayo治疗确认的客观缓解率为47%(95%CI:38-57),其中完全缓解率为4%,所有完全缓解均发生在转移性CSCC患者中。在最后一次评估时,有些患者持续缓解时间超过15个月,有61%的患者缓解持续至少6个月。安全性方面,最常见的不良反应包括:疲劳、皮疹和腹泻。
作为有条件批准的一部分,赛诺菲和再生元需要提供来自EMPOWER-CSCC-1研究的额外数据,包括一个新加入的试验组的结果,以进一步确认Libtayo的利益风险状况。
CSCC是一种常见的皮肤癌症,在欧盟尚无批准治疗晚期CSS的药物。如果获得批准,Libtayo将成为欧盟首个也为唯一一个被批准用于晚期CSCC患者的治疗药物。在美国,Libtayo于2018年9月获FDA批准,成为美国市场中首个获批治疗晚期CSCC的药物。
4.默沙东Keytruda(可瑞达)治疗PD-L1阳性胃癌关键性III期临床失败
2019年4月25日,肿瘤免疫治疗巨头默沙东(Merck & Co)公布了PD-1肿瘤免疫疗法Keytruda(可瑞达,通用名:pembrolizumab,派姆单抗)治疗胃癌关键III期研究KEYNOTE-062最终分析得出的顶线结果。该研究评估了Keytruda作为单药以及联合化疗(顺铂与5-氟尿嘧啶或与卡培他滨)一线治疗晚期胃或胃食管交界腺癌。
结果显示,在研究的单药治疗组中,Keytruda达到了一个主要终点:在整个PD-L1阳性(合并阳性评分[CPS]≥1)意向性治疗(ITT)患者群体中,与标准护理化疗在总生存期(OS)方面表现出非劣效性。然而,在联合治疗组中,与化疗相比,Keytruda联合化疗在OS(CPS≥1或CPS≥10)或无进展生存期(PFS)(CPS≥1)方面没有显示出优越性。该研究中,Keytruda的安全性与此前在胃癌研究中观察到的安全性一致。研究结果将在2019年6月2日在芝加哥举行的美国临床肿瘤学会(ASCO)第55届年会上发布,并将与监管机构讨论。

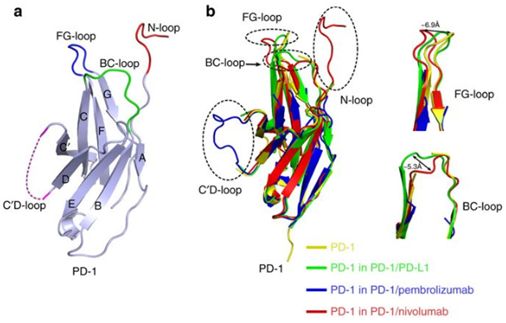
图4. 纳武单抗和派姆单抗靶向结合蛋白PD-1的环状结构,图片来自Nature Communications, 2017, doi:10.1038/ncomms14369。
默沙东研究实验室首席医疗官、高级副总裁兼全球临床开发负责人Roy Baynes博士表示,“胃癌历来难以治疗,不幸的是,在许多国家胃癌仍然与高死亡率有关,尤其是在转移阶段。尽管这项研究并没有达到所有的主要终点,但Keytruda单药疗法确实显示了在整个患者群体中的非劣效总生存期。我们衷心感谢参与这这项研究的患者和研究人员,并期待与医疗界分享详细的研究结果。”
2017年9月,美国FDA加速批准Keytruda作为三线治疗方案,用于既往已接受2种或多种疗法(包括含氟嘧啶和含铂化疗,HER2/neu靶向疗法[如果适合的话])治疗但病情进展、肿瘤表达PD-L1(CPS≥1)的复发性局部晚期或转移性胃癌或胃食管交界癌患者。
KEYNOTE-062研究是用于这一加速三线批准的潜在验证性试验。除了KEYNOTE-062之外,默沙东胃癌项目中还包括一线治疗III期研究KEYNOTE-811和KEYNOTE-859,以及新辅助和辅助治疗研究KEYNOTE-585。
5.葛兰素史克单抗药物Benlysta获美国FDA批准用于儿童系统性红斑狼疮
2019年4月26日,英国制药巨头葛兰素史克(GSK)宣布,美国FDA通过优先审查已批准狼疮药物Benlysta用于5岁及以上系统性红斑狼疮(SLE)儿童患者。值得一提的是,Benlysta是第一种在美国市场获批用于治疗SLE儿童患者的药物。
Benlysta的活性成分为belimumab(贝利木单抗),是一种人源IgG1γ单抗,可特异性结合可溶性B细胞刺激因子(BLyS),阻止BLyS与B细胞结合,促进B细胞凋亡,从而治疗SLE。

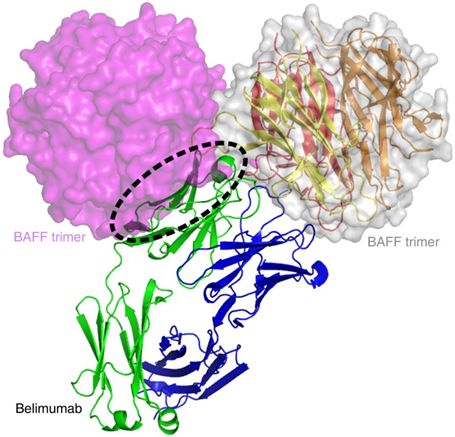
图5. belimumab阻断两个BAFF三聚体彼此之间的相互作用,图片来自Nature Communications, 2018, doi:10.1038/s41467-018-03620-2。
此次批准,是基于上市后承诺研究(PLUTO研究)的数据。该研究评估了10 mg/kg剂量Benlysta联合标准疗法相对于安慰剂联合标准疗法治疗5-11岁(n=13)、12-17岁(n=80)SLE儿童患者治疗一年的疗效、安全性和药代动力学。
根据系统性红斑狼疮反应指数(SRI)反应率评估,接受Benlysta联合标准治疗(52.8%)的患者与接受安慰剂联合标准治疗(43.6%)的患者相比,在52周时获得有临床意义疾病活动改善的儿童比例在数值上更高。经历一次以上不良事件(AE)和一次严重不良事件(SAE)的患者比例方面,Benlysta治疗组分别为79.2%和17.0%,安慰剂组分别为82.5%和35.0%。导致停药的不良事件包括狼疮性肾炎、甲型肝炎、高转氨酶血症、急性胰腺炎、疱疹后神经痛、视网膜血管炎和胰腺炎。
Benlytsa是近50多年来获批治疗SLE的首个新药,该药有2种剂型。2011年,静脉注射剂型(IV)Benlysta获批用于治疗自身抗体阳性的SLE成人患者,该药每4周输注一次,剂量根据体重调整(10mg/kg),耗时约1个小时。2017年7月,皮下注射剂型(SC)Benlysta获批,用于正在接受标准治疗的活动性、自身抗体阳性SLE成人患者,此次批准,也标志着治疗SLE的首个皮下注射药物获批,患者通过培训后可自行皮下注射给药,该剂型将为SLE患者群体提供一种重要的治疗选择。
6.新型抗炎药Skyrizi获美国FDA批准治疗中度至重度斑块型银屑病
2019年4月23日,生物技术巨头艾伯维(AbbVie)宣布,美国FDA已批准Skyrizi(risankizumab-rzaa),用于适合系统疗法或光疗的中度至重度斑块型银屑病成人患者的治疗。在临床试验中,Skyrizi具有很高的、持久的皮肤斑块清除率——大部分患者(82%和81%)接受Skyrizi治疗一年后达到90%皮肤斑块清除(PASI90),多数患者(56%和60%)达到完全皮肤斑块清除(PASI100)。
Skyrizi的活性药物成分为risankizumab,这是一种单克隆抗体药物,通过特异性靶向IL-23p19亚基选择性阻断体内免疫炎性介质白细胞介素-23(IL-23),IL-23是一种细胞因子,被认为在许多慢性免疫性疾病中起着关键作用。
艾伯维公司表示,Skyrizi预计将在5月初在美国上市。该药通过皮下注射给药,推荐剂量为150mg(2针,75mg/针),在第0、4周分别用药一次,之后每3个月(12周)用药一次。Skyrizi可在医院注射,也可经培训后自我注射。
此次批准,是基于4项随机、安慰剂和/或阳性药物对照、关键性III期临床研究(ultIMMa-1、ultIMMa-2、IMMvent、IMMhance)的数据。这些研究共入组了2000多例中度至重度斑块型银屑病成人患者。结果显示,Skyrizi治疗仅仅16周后就显著改善了皮肤银屑病斑块清除,并在治疗一年内(52周)维持了斑块清除。
值得一提的是,此次批准,也标志着Skyrizi赢得的全球第3个监管批准。今年3月底,Skyrizi获日本批准,用于对常规疗法反应不足的斑块型银屑病、泛发性脓疱型银屑病(GPP)、红皮病型银屑病、银屑病关节炎成人患者的治疗。上周,Skyrizi获加拿大批准,用于适合系统疗法或光疗的中度至重度斑块型银屑病成人患者的治疗。目前,Skyrizi也正在接受欧盟的监管审查。今年3月初,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)推荐批准Skyrizi用于适合系统疗法的中度至重度斑块型银屑病成人患者,欧盟委员会预计在今年上半年做出审查决定。
7.第4款CGRP靶向偏头痛抗体疗法eptinezumab在美国进入审查
2019年4月22日,作为一家专注于开发新型抗体疗法用于治疗偏头痛的生物制药公司,Alder BioPharmaceuticals宣布,美国FDA已受理eptinezumab预防偏头痛的生物制品许可申请(BLA)。如果获得批准,eptinezumab将成为预防偏头痛的首个每季度一次的静脉输液疗法。
该药BLA的提交,是基于2项III期研究PROMISE 1(NCT02559895)和PROMISE 2(NCT02974153)的数据。这2项研究分别评估了eptinezumab治疗发作性偏头痛(n=888)和慢性偏头痛(n=1072)的疗效和安全性,数据显示,均达到了全部主要终点和关键次要终点。研究中,eptinezumab安全性和耐受性与安慰剂相似。
eptinezumab是一种人源化IgG1单克隆抗体,靶向结合降钙素相关基因肽(CGRP)。CGRP是一种神经肽,已被证明在偏头痛发作时释放,可能是偏头痛发作的诱因。目前,CGRP已成为偏头痛药物研发的热门靶点。
用药方面,eptinezumab每3个月一次静脉输注,Aimovig和Emgality均为每月一次皮下注射,Ajovy则可每月一次或每3个月一次皮下注射。
截至目前,已有3款以CGRP及其受体为靶点的单抗类偏头痛疗法上市,分别为安进和诺华的Aimovig(靶向CGRP受体)、梯瓦的Ajovy(靶向CGRP)、礼来的Emgality(靶向CGRP)。
8.单抗药物inebilizumab治疗神经脊髓炎频谱障碍获美FDA突破性药物资格
2019年4月18日,Viela Bio公司宣布,美国FDA已授予抗CD19单抗inebilizumab(以前称MEDI-551)治疗视神经脊髓炎频谱障碍(NMOSD)的突破性药物资格(BTD)。此前,FDA和欧洲药品管理局(EMA)分别于2016年3月和2017年3月授予了inebilizumab治疗NMOSD的孤儿药资格。

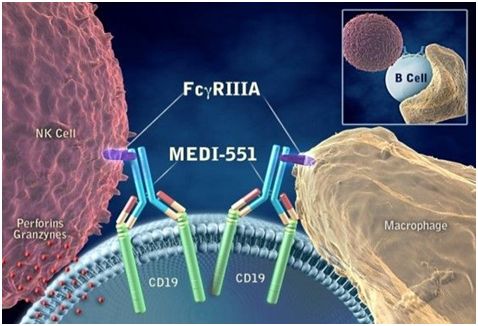
图6.inebilizumab(MEDI-551)作用机制
FDA授予inebilizumab BTD,是基于关键性N-MOmentum研究的数据。该研究是一项随机、双模拟、安慰剂对照研究,共入组了231例NMOSD患者,包括存在或不存在AQP4-IgG抗体的患者。研究中,患者随机分为2组,分别接受2次静脉注射inebilizumab单药疗法或安慰剂,并随访6.5个月。之后,患者进入开放标签扩展期,所有患者每6个月一次接受一次inebilizumab治疗。主要终点是从治疗开始到NMOSD发作的时间。
结果显示,该研究达到了主要终点和关键次要终点:与安慰剂组相比,inebilizumab治疗组经历一次NMOSD发作的风险显著降低了77%。此外,与安慰剂组相比,inebilizumab治疗组残疾恶化显著降低。该研究中,inebilizumab具有良好的安全性和可接受的耐受性。
inebilizumab是一种人源化单抗,与CD19具有很高的亲和力,CD19是一种广泛表达于B细胞的蛋白质,包括分泌抗体的浆母细胞和一些浆细胞。inebilizumab与CD19结合后,这些细胞迅速从循环系统中耗竭。
9.抗炎药Taltz治疗放射学阴性中轴型脊柱关节炎III期研究获得成功
2019年4月22日,美国制药巨头礼来(Eli Lilly)宣布,评估抗炎药Taltz(ixekizumab)治疗放射学阴性中轴型脊柱关节炎(nr-axSpA)的III期临床研究COAST-X达到了主要终点和全部次要终点。这些结果为Taltz治疗nr-axSpA患者治疗中的潜在作用提供了临床证据。
COAST-X是一项多中心、随机、双盲、安慰剂对照、52周研究,评估了Taltz在既往未接受生物类疾病修饰抗风湿药物(bDMARD,初治)的nr-axSpA患者中的疗效和安全性。研究的主要终点是国际脊柱关节炎学会评估改善40%(ASAS40)。
结果显示,根据达到ASAS40缓解的患者比例评价,与安慰剂相比,Taltz在第16周和第52周均达到了主要终点,显示nr-axSpA症状和体征具有统计学意义的显著改善。此外,Taltz在第16周和第52周也达到了主要的次要终点,包括:强直性脊柱炎活动度评分(ASDAS)显著改善、巴斯强直性脊柱炎活动度评分(BASDAI)的显著改善、达到低疾病活动(ASDAS<2.1)的患者比例、骶髂关节炎显著改善(第16周,采用MRI评价)、36项短期健康调查(SF-36)躯体健康总评(PCS)评分的显著改善。该研究中,Taltz的安全概况与之前报告III期研究中一致,未检测到新的安全信号。
Taltz的活性药物成分为ixekizumab,这是一种单克隆抗体,针对具有促炎作用的细胞因子白介素-17A(IL-17A)具有较高的亲和力和特异性,可抑制IL-17A与IL-17受体的结合。ixekizumab不会与细胞因子IL-17B、IL-17C、IL-17D、IL-17E或IL-17F结合。IL-17A是一种天然存在的细胞因子,参与正常的炎症和免疫反应。对于银屑病患者而言,IL-17A在驱动角化细胞(皮肤细胞)过度增殖和活化方面发挥了重要作用。
Taltz通过皮下注射给药,在美国市场,该药于2016年3月首次获批,成为继诺华重磅抗炎药Cosentyx(secukinumab)之后美国上市的第2款IL-17A单抗药物。目前,Taltz已获批的适应症包括:(1)治疗活动性银屑病关节炎(PsA)成人患者;(2)治疗适合系统疗法或光疗的中度至重度斑块型银屑病成人患者。
10.诺华brolucizumab治疗湿性AMD在美国进入优先审查
2019年4月15日,瑞士制药巨头诺华(Novartis)宣布,美国FDA已受理新一代眼科药物brolucizumab(RTH258)治疗湿性年龄相关性黄斑变性(wet-AMD,又名新生血管性AMD,nAMD)的生物制品许可申请(BLA)。值得一提的是,诺华使用了一张优先审评券(PRV)来加速该BLA审查,将把审查周期由常规的10个月缩短至6个月。如果获得批准,诺华预计将在2019年将brolucizumab推向市场。
此次BLA,主要基于III期HAWK研究(NCT02307682)和HARRIER研究(NCT02434328)的数据。这2项研究均为前瞻性、随机、双盲、多中心研究,在wet-AMD患者中开展,评估了brolucizumab相对于再生元重磅眼科产品Eylea(aflibercept,阿柏西普)的疗效和安全性。
结果显示,2项研究均达到了主要终点,在治疗第48周,brolucizumab(6mg)在改善视力方面疗效非劣效于Eylea,具体数据为:HAWK研究和HARRIER研究中,brolucizumab(6mg)治疗组最佳矫正视力(BCVA)相对基线的平均变化分别为6.6个字母(Eylea治疗组为6.8个字母)和6.9个字母(Eylea治疗组为7.6个字母)。
此外,brolucizumab(6mg)在疾病进展关键指标的3个次要终点方面也表现出优势:疾病活动度、中央视野视网膜厚度、视网膜液(视网膜内液和/或视网膜下液)。具体数据为:(1)在治疗第48周,与Eylea治疗组相比,brolucizumab(6mg)治疗组疾病活动的患者比例更低(HAWK研究:23.5% vs 33.5%,p=0.0022;HARRIER研究:21.9% vs 31.4%,p=0.0022);(2)在治疗第48周,与Eylea治疗组相比,brolucizumab(6mg)治疗组视网膜液关键标志物显著减少:存在视网膜内液(IRF)和/或视网膜下液(SRF)的患者比例方面,HAWK研究中减少31%(p<0.0001)、HARRIER研究中减少26%(p<0.0001)。
值得一提的是,HAWK研究和HARRIER研究是在wet-AMD患者中前瞻性地证实brolucizumab以每12周一次(3个月一次)给药方案启动治疗表现出显著疗效的首批也是唯一一批全球性头对头临床研究。

图7. brolucizumab等几种单抗药物分子的分子量
brolucizumab(RTH258)是一种~26 kDa的人源化单链抗体可变区片段(scfv),针对血管内皮生长因子-A(VEGF-A)的所有亚型均有很强的抑制作用,并具有很高的亲和力。在临床前研究中,brolucizumab通过阻断配体-受体相互作用来抑制VEGF受体的激活。增加的VEGF途径信号与病理性眼部血管生成和视网膜水肿有关。在脉络膜视网膜血管疾病患者中,抑制VEGF途径可抑制新生血管病变的生长,缓解视网膜水肿,改善视力。
其实,制药公司和科学家们针对单抗药物的临床研究不胜枚举,以上罗列的仅是其中的一小部分。当然,其中的一些单抗药物虽然已开展人体临床试验,但是仍然停留在I期或II期临床试验阶段,参与临床试验的患者人数仍然偏少,仍需通过招募更多的患者人数来开展III期临床试验。随着科学家们在单抗药物制造技术方面不断取得新的突破,比如人杂交瘤技术、EB病毒(EBV)转化 B 淋巴细胞技术、噬菌体展示技术、转基因小鼠抗体制备技术和单个B细胞抗体制备技术等不断涌出,具有更好性能的第四代单抗药物越来越多涌现出来,从而有望为更多患者带来福音。在未来,科学家们将从病理学、分子生物学、基因、蛋白和组学等不同角度深入探究单抗药物在正常的生理过程和疾病发生的重要作用及其作用机理,人们最终有朝一日能够开发出更多更好的单抗药物,用于治疗癌症、炎症、肥胖、糖尿病、血液系统疾病、神经系统疾病和遗传疾病等一系列疾病。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


