GSK BCMA靶向疗法获FDA突破性药物资格
英国制药巨头葛兰素史克(GSK)近日宣布,美国食品和药物管理局(FDA)已授予新型抗B细胞成熟抗原(BCMA)单克隆抗体-药物偶联物(ADC)GSK2857916作为单药疗法用于既往接受至少3种疗法治疗失败(包括一种抗CD38抗体疗法,以及对一种蛋白酶抑制剂和一种免疫调节剂难治)的多发性骨髓瘤(MM)患者的突破性药物资格(BTD)。在欧盟方面,欧洲药品管理局(EMA)于今年10月授予了
Diabetes:靶向miR-204有望改善糖尿病药物的疗效
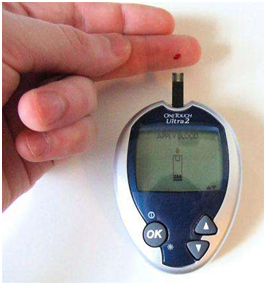
血糖检测,图片来自Wikipedia。2017年11月13日/生物谷BIOON/---糖尿病是一种由高血糖引起的疾病。每10个美国成年人中就有1人患上这种疾病,而且这种疾病导致过早死亡的风险增加一倍。美国有超过3000万人患有糖尿病。这种疾病是第七大死亡原因,同时它也会导致失明和下肢截肢。在过去的15年里,美国阿拉巴马大学伯明翰分校内分泌学家Anath Shalev博士揭示出一种至关重要的β细胞通
诺华靶向抗癌组合疗法Tafinlar+Mekinist在美国斩获第三个突破性药物资格(BTD)
2017年10月25日讯 /生物谷BIOON/ --瑞士制药巨头诺华(Novartis)肿瘤管线近日在美国监管方面传来喜讯。美国食品和药物管理局(FDA)已授予靶向抗癌组合疗法Tafinlar+Mekinist用于III阶段BRAF V600突变阳性黑色素瘤患者手术完全切除后辅助治疗的突破性药物资格(BTD)。值得一提的是,这也是该组合第三次被授予BTD,之前FDA已授予该组合治疗非小
FDA授予BioMarin A型血友病基因疗法BMN270突破性药物资格
2017年10月29日讯 /生物谷BIOON/ --知名罕见病制药商BioMarin近日宣布,美国食品和药物管理局(FDA)已授予实验性基因疗法valoctocogene roxaparvovec(又名BMN270)突破性药物资格(BTD),该基因疗法开发用于重度A型血友病患者的治疗。在欧盟,今年年初欧洲药品管理局(EMA)授予了BMN270优先药物资格(PRIME)。此外,在美国和欧
基因靶向药物或有望减缓帕金森疾病的进展
2017年10月27日 讯 /生物谷BIOON/ --在过去10年里,作为一名专门从事帕金森疾病研究的医生,我(原文笔者)常常会被很多患者问道帕金森疾病是否能被彻底治愈,我常常会很乐观地回答这个问题,但实际上在帕金森疾病的临床试验中有一连串的失败案例。然而,最近有研究人员通过研究鉴别出了和帕金森疾病相关的基因,这或许就为后期我们开发帕金森疾病新型疗法提供了新的希望;理解这些基因发生错误诱发帕金森疾
Ignyta新型靶向抗癌药entrectinib获欧盟优先药物(PRIME)资格
2017年10月22日讯 /生物谷BIOON/ --Ignyta是一家专注于肿瘤精准医疗的生物技术公司,近日,该公司宣布欧洲药品管理局(EMA)已授予其实验性靶向抗癌药entrectinib用于治疗既往已接受治疗但病情进展或没有可接受的标准疗法的NTRK融合基因阳性、局部晚期或转移性实体瘤儿科患者和成人患者的优先药物资格(Priority Medicine,PRIME)。在美国,FDA于今年5月授
安进靶向药物Kyprolis每周一次方案治疗多发性骨髓瘤III期临床疗效显著优于每周2次方案
2017年10月28日讯 /生物谷BIOON/ --美国生物技术巨头安进(Amgen)近日公布了多发性骨髓瘤(MM)靶向药物Kyprolis(carfilzomib,卡非佐米)III期临床研究ARROW的顶线数据。ARROW是一项随机、开放标签III期研究,入组了478例复发性和难治性MM患者,这些患者之前已接受了至少2种但不超过3种疗法,包括武田靶向药物Velcade(万珂,通用名:
Oncotarget:科学家有望开发出彻底根治HPV相关癌症的靶向性疗法
2017年10月4日 讯 /生物谷BIOON/ --近日,一项刊登在国际杂志Oncotarget上的研究报告中,来自乔治敦大学医学中心的研究人员通过研究阐明了人乳头瘤病毒(HPV)致癌的生物学机制,相关研究或为后期研究人员开发治疗HPV相关癌症的新型疗法提供新的思路。图片来源:medicalxpress.comHPV是引发大多数的宫颈癌、头颈癌及直肠癌的元凶,但截止到目前为止治疗相应癌症的疗法仅仅
Ophthotech湿性年龄相关性黄斑变性药物III期临床失败
2017年8月14日讯/生物谷BIOON/——总部设在纽约的Ophthotech公司(OPHT)宣布,其Fovista(pegpleranib)III期临床试验未达到主要终点,宣告失败。该试验评估了Fovista与Eylea(aflibercept)或Avastin(贝伐珠单抗)联用,相比于Eylea或Avastin单独用于湿性年龄相关性黄斑变性(AMD)的患者的疗效。Fovista没有显示出任何
美FDA授予罗氏抗癌药Zelboraf突破性药物资格和优先审查资格
瑞士制药巨头罗氏(Roche)旗下基因泰克(Genentech)近日宣布,美国食品和药物管理局(FDA)已受理靶向抗癌药Zelboraf(vemurafenib,维罗非尼)治疗BRAF V600突变阳性Erdheim-Chester病(ECD)的补充新药申请(sNDA)并授予了优先审查资格(PRD),其审查周期将由常规的10个月缩短至6个月。同时,FDA还授予了Zelboraf治疗该适应症的突破性