《自然》子刊:破解癌细胞“老而不死”之谜!中国科学家找到杀死衰老癌细胞的新方法
来源:奇点糕 2022-12-19 12:07
岁月不饶人,也没饶了癌细胞。即使强如癌细胞也免不了会衰老,然而细胞衰老对肿瘤发展的影响却表现出两面性。
岁月不饶人,也没饶了癌细胞。即使强如癌细胞也免不了会衰老,然而细胞衰老对肿瘤发展的影响却表现出两面性。
一方面,细胞衰老持续性地阻碍了细胞周期运转,抑制肿瘤生长。另一方面,衰老细胞可以引起慢性炎症、免疫抑制并促进肿瘤细胞的间质-上皮转化,从而促进肿瘤免疫逃逸以及转移[1,2,3]。
因此,虽然肿瘤细胞发生衰老代表着治疗的初步理想结果,但衰老细胞的长期存在可能是有害的。这提示我们或许可以通过化疗等手段诱导肿瘤细胞的衰老,随后通过药物清除衰老细胞避免其长期存在,给予肿瘤双重打击[4]。
Senolytics是一类可以清除衰老细胞的药物,或许可以应用于上述的治疗策略。但是目前的局限之处在于我们缺少一些特异性针对衰老肿瘤细胞的、低毒的Senolytic。
近期,来自荷兰癌症研究所的René Bernards/王力勤团队和上海市肿瘤研究所覃文新团队联合在《自然·癌症》上发表研究成果[5]。
他们发现衰老的肿瘤细胞会上调cFLIP表达以阻止死亡受体5(DR5)介导的细胞凋亡。而抑制溴结构域包含蛋白2(BRD2)可以减少cFLIP,使衰老的肿瘤细胞对DR5介导的凋亡更加敏感,因此联用BRD2抑制剂与DR5激动性抗体可以杀死多种衰老的肿瘤细胞。
在动物模型中,“细胞衰老诱导剂+BRD2抑制剂+DR5激动性抗体”组合可以达到更好的抗肿瘤效果。

论文首页截图
为了寻找衰老肿瘤细胞的阿喀琉斯之踵,研究团队使用了全基因组CRISPR-Cas9敲除筛选体系,以寻找那些敲除后能够显著促进衰老肿瘤细胞死亡的基因。
他们发现,在衰老诱导剂(极光激酶A抑制剂Alisertib、PLK4抑制剂CFI-400945和拓扑异构酶II抑制剂Etoposide)处理后的A549细胞中敲除CFLAR(编码cFLIP)可以显著促进衰老肿瘤细胞的死亡。
接下来,研究团队通过cFLIP敲除细胞系验证了上述CRISPR-Cas9筛选的结果,并且发现敲除cFLIP是通过增加细胞凋亡的方式促进衰老肿瘤细胞死亡的。
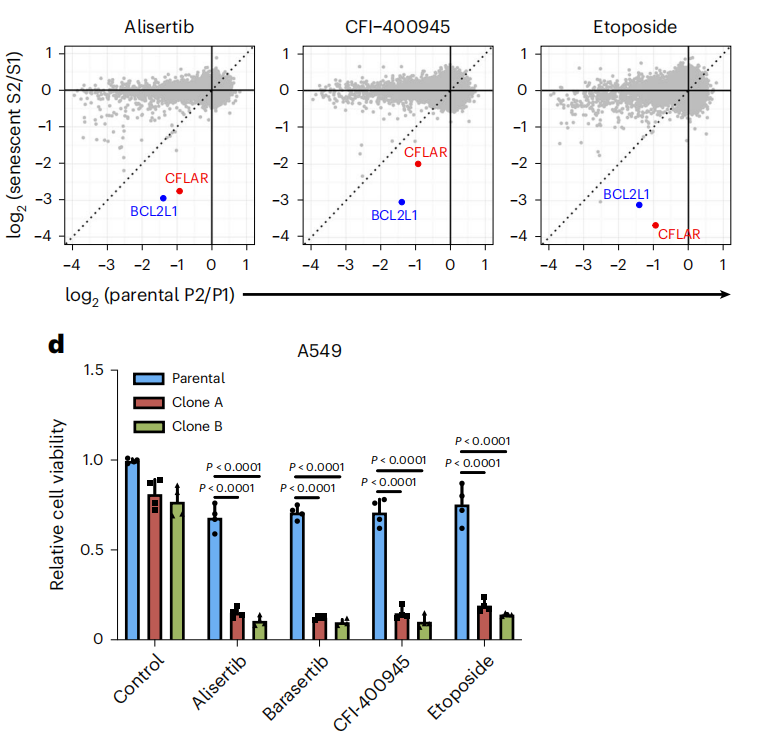
敲除cFLIP促进衰老肿瘤细胞发生caspase3/7依赖的细胞凋亡
为了探究为什么敲除cFLIP之后可以促进衰老肿瘤细胞的凋亡,研究团队对经过Alisertib处理的A549细胞进行转录组测序以及分析。
他们发现,衰老的肿瘤细胞中NF-κB信号显著增强,而cFLIP正是NF-κB的下游基因。Q-PCR结果表明,衰老的肿瘤细胞中cFLIP、死亡受体DR5及其配体TRAIL等多种NF-κB下游基因mRNA显著增加。这一现象在多种肿瘤细胞中普遍存在。
由于cFLIP具有抑制DR5介导的细胞凋亡的作用[6],研究团队猜想,NF-κB活性在衰老细胞中上调,这导致DR5及其配体TRAIL的表达增加,从而引发衰老细胞凋亡。然而,随着cFLIP的增加,衰老细胞免于凋亡。
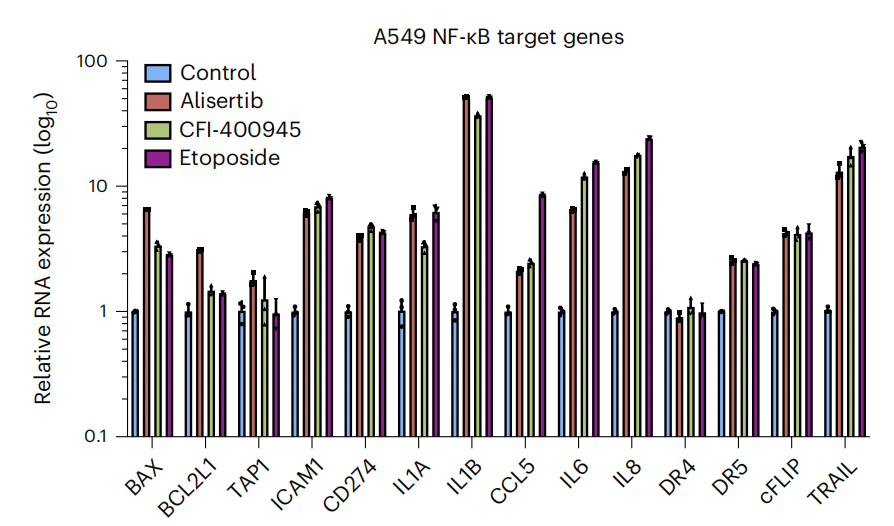
衰老肿瘤细胞中NF-κB活性增强,cFLIP、DR5和TRAIL表达增加
既然衰老的肿瘤细胞会上调表达DR5,那么使用TRAIL处理是否可以促进衰老肿瘤细胞的死亡呢?
研究团队使用重组三聚体TRAIL蛋白处理衰老的肿瘤细胞,发现这可以显著地促进衰老肿瘤细胞的凋亡,并且这种作用依赖于DR5。
由于TRAIL的生物利用率很低,并且会被诱饵受体结合,研究团队尝试使用DR5的激动性抗体conatumumab处理衰老肿瘤细胞。他们发现,conatumumab通过引起细胞凋亡选择性杀死衰老肿瘤细胞。
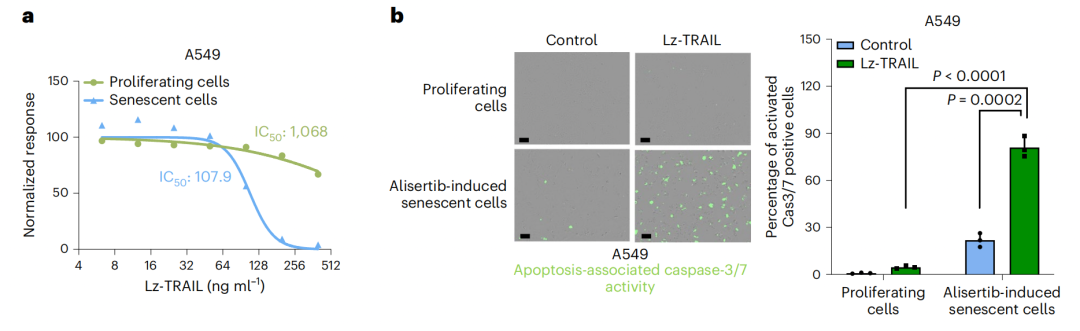
TRAIL以及DR5激动性抗体可以选择性清除衰老的肿瘤细胞
为了探究conatumumab能否应用在“诱导肿瘤细胞衰老—清除衰老细胞”抗肿瘤策略中,研究团队构建了肝细胞癌患者来源的异种移植 (PDX) 模型,并给予小鼠Alisertib、Barasertib(两种细胞衰老诱导剂)以及conatumumab单药治疗或者组合治疗。
他们发现,单用时仅Alisertib有一定疗效,但是将conatumumab与Alisertib或Barasertib联合使用则可以显著改善治疗效果。
肿瘤组织样本检测发现,Alisertib治疗可以诱导肿瘤细胞衰老,而在联合治疗组中,肿瘤内衰老细胞的比例显著降低。这表明联合治疗清除了衰老的肿瘤细胞并显著改善了抗肿瘤治疗效果。
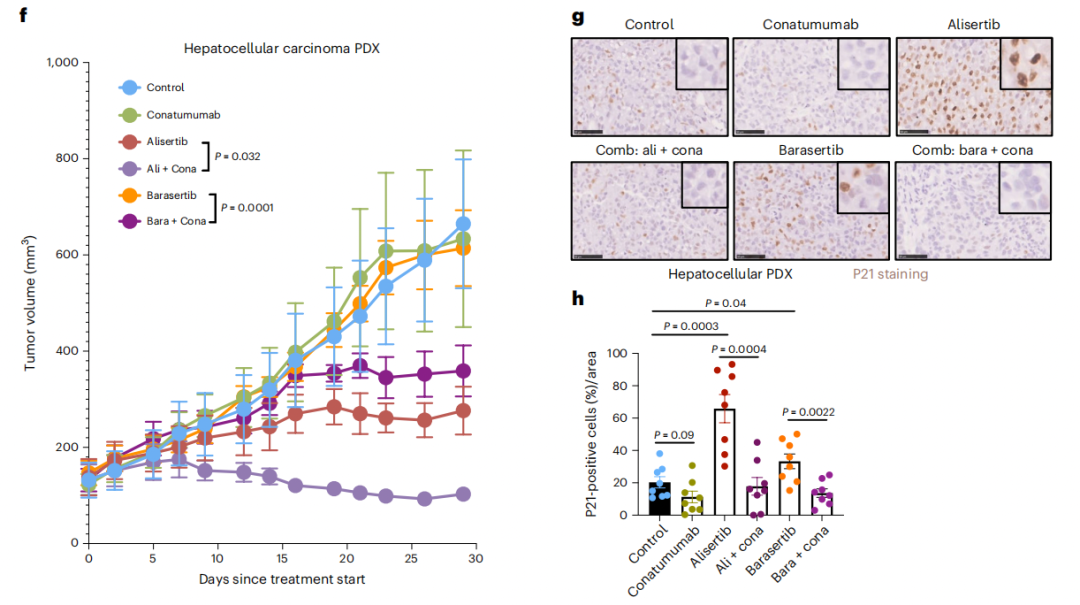
将DR5激动性抗体与衰老诱导剂联用显著增强抗肿瘤治疗效果
由于几种DR5激动性抗体在临床上显示出较多的毒副作用[7],因此研究团队希望继续改进治疗策略为了进一步降低DR5的抗体用量。
为此,研究团队再次进行了CRISPR/Cas9筛选,以寻找敲除后可使PC9肺癌细胞对DR5激动性抗体治疗敏感的基因。
他们发现,敲除BRD2可以使肿瘤细胞对conatumumab处理更加敏感(这里用的并不是衰老肿瘤细胞,而是未经衰老诱导剂处理的细胞)。随后他们使用小分子抑制剂NEO2734证实了筛选结果。
重要的是,使用能够杀死肿瘤细胞的相同药物浓度的conatumumab和NEO2734并不会杀死人类原代视网膜细胞(Rep1)和成纤维细胞(BJ),表明这种联合用药策略能够显著降低毒副作用。
不过,为何抑制BRD2可以增加肿瘤细胞对DR5激动性抗体的敏感性呢?
为了探究这个问题,研究团队对NEO2734处理的肿瘤细胞进行了转录组分析。他们发现,NEO2734处理能够显著降低cFLIP的表达。这与之前在衰老细胞中进行的CRISPR筛选结果一致,所以研究团队测试了BRD2抑制剂与DR5激动性抗体联合处理是否能够有效清除衰老肿瘤细胞。
结果显示,低剂量的BRD2抑制剂与DR5激动性抗体处理优先清除了衰老的肿瘤细胞。

抑制BRD2降低cFLIP的表达并增强肿瘤细胞对DR5激动性抗体的敏感性;BRD2抑制剂+DR5激动性抗体可以有效并优先清除衰老肿瘤细胞
最后,研究团队在小鼠体内探究了“细胞衰老诱导剂+BRD2抑制剂+DR5激动性抗体”组合的抗肿瘤效果。结果显示,单药治疗有一定的抑制肿瘤生长效果,但是三药联用极大地改善了治疗效果。
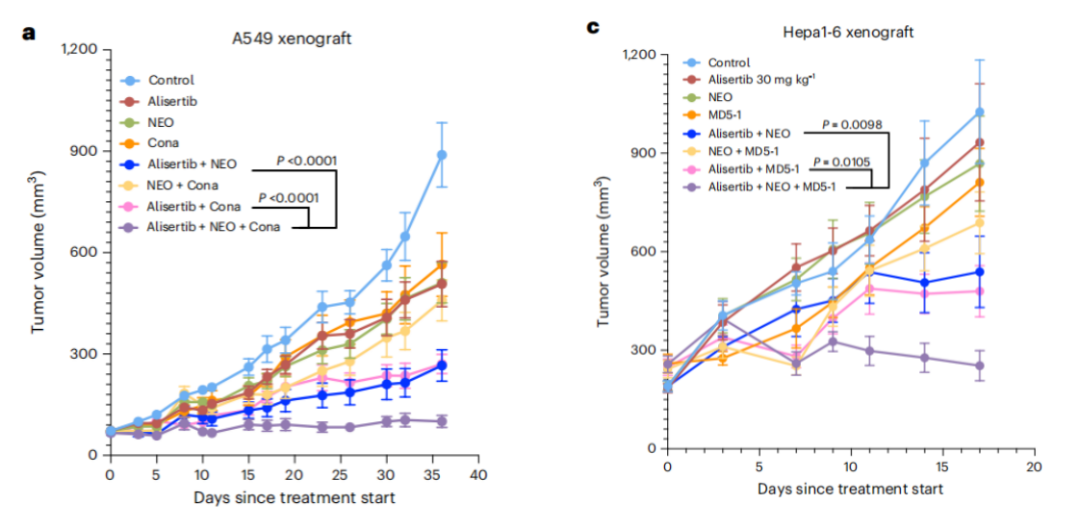
“细胞衰老诱导剂+BRD2抑制剂+DR5激动性抗体”药物组合能够有效抑制肿瘤生长
这项研究成果显示,衰老肿瘤细胞中死亡受体DR5及其配体TRAIL上调,说明衰老肿瘤细胞已经为死亡做好了准备,但是cFLIP抑制了肿瘤细胞的凋亡。抑制BRD2,可以降低肿瘤细胞内cFLIP的表达,使肿瘤细胞对DR5介导的细胞凋亡更加敏感。因此,将细胞衰老诱导剂、BRD2抑制剂以及DR5激动剂联用可以十分有效地清除肿瘤细胞。
此外,这项研究成果也表明,肿瘤细胞内NF-κB活性增加可能代表着其为死亡做好了准备(DR5以及TRAIL上调),只是cFLIP阻碍了其死亡。因此,抑制BRD2或许对一些NF-κB 驱动的肿瘤具有治疗作用。
参考文献:
1.Kuilman, T. et al Oncogene-induced senescence relayed by an interleukin-dependent inflammatory network. Cell 133, 1019–1031 (2008)
2.Demaria, M. et al Cellular senescence promotes adverse efects of chemotherapy and cancer relapse. Cancer Discov. 7, 165–176 (2017)
3.Faget, D. V., Ren, Q. & Stewart, S. A. Unmasking senescence: context-dependent efects of SASP in cancer. Nat. Rev. Cancer 19, 439–453 (2019)
4.Wang L, Lankhorst L, Bernards R. Exploiting senescence for the treatment of cancer. Nat Rev Cancer. 2022;22(6):340-355. doi:10.1038/s41568-022-00450-9
5.Wang, L., Jin, H., Jochems, F. et al. cFLIP suppression and DR5 activation sensitize senescent cancer cells to senolysis. Nat Cancer 3, 1284–1299 (2022). https://doi.org/10.1038/s43018-022-00462-2
6.Shirley S, Micheau O. Targeting c-FLIP in cancer. Cancer Lett. 2013;332(2):141-150. doi:10.1016/j.canlet.2010.10.009
7. Finnberg, N. K. et al Agonists of the TRAIL death receptor DR5 sensitize intestinal stem cells to chemotherapy-induced cell death and trigger gastrointestinal toxicity. Cancer Res. 76, 700–712 (2016).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


