《癌细胞》:南方医院团队发现放疗不能“隔山打牛”、发挥远隔抗癌效应的关键原因
来源:奇点糕 2025-03-15 15:03
经放疗的肿瘤会分泌纤溶酶原激活物抑制剂1(PAI-1)进入血流,抵达未被放疗的远处癌灶,并诱导癌灶内出现一类特殊的癌症相关成纤维细胞(CAFs),把奉命赶来抗癌的CD8+T细胞拒之门外!
南方医科大学南方医院董忠谊、吴德华、白雪、官键等研究者在Cancer Cell期刊发表的最新研究成果,终于揭示了制约放疗后远隔效应发生的原因:经放疗的肿瘤会分泌纤溶酶原激活物抑制剂1(PAI-1)进入血流,抵达未被放疗的远处癌灶,并诱导癌灶内出现一类特殊的癌症相关成纤维细胞(CAFs),把奉命赶来抗癌的CD8+T细胞拒之门外!
研究发现,被放疗肿瘤释放的PAI-1会通过LRP1/p65信号轴,将未被放射病灶中的周细胞(pericyte)转化为高表达分泌型卷曲相关蛋白2(SFRP2)的CAFs,而这些CAFs会在血管周围营造阻碍CD8+T细胞募集的“敌意微环境”(hostile niche),阻止远隔效应发生,因此针对SFRP2或PAI-1进行干预,有望增强免疫治疗+放疗联合方案的临床疗效。
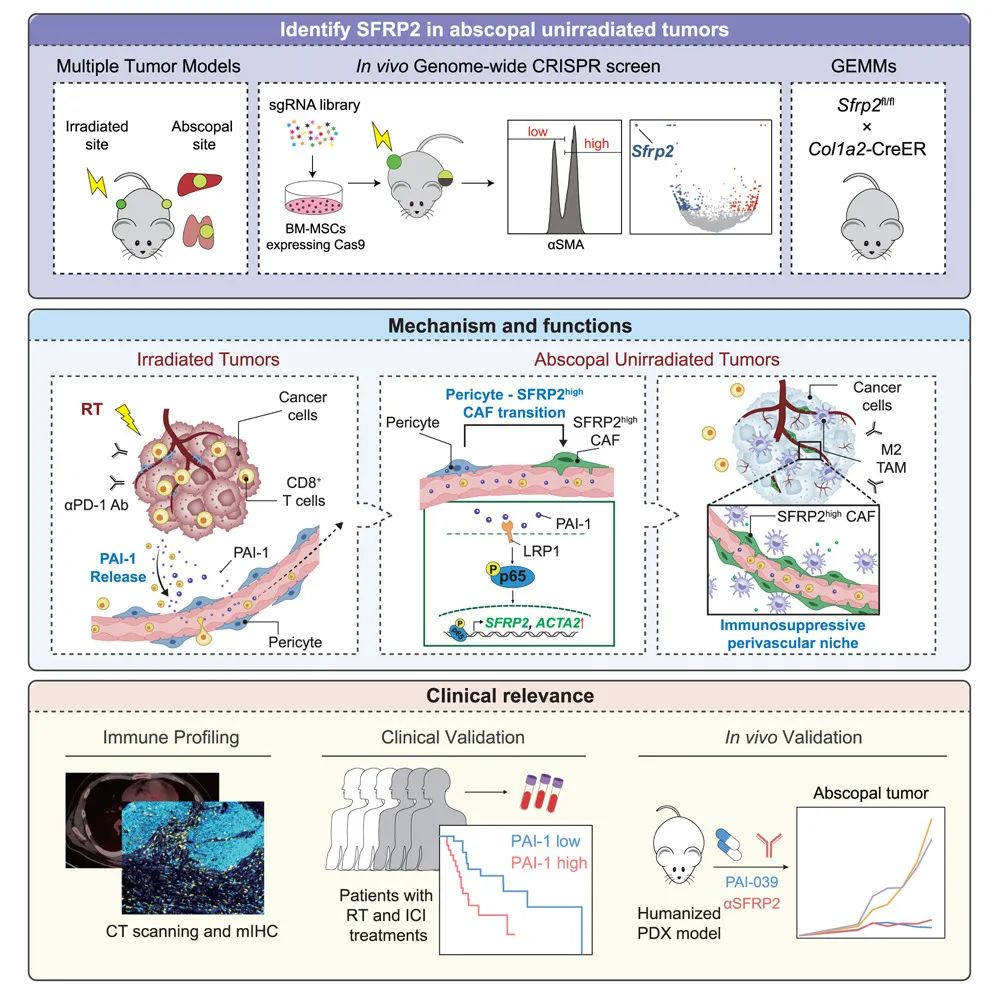
一图总结论文核心内容
本次研究首先在多种癌症模型小鼠身上尝试复现放疗远端效应,并评估发生(仅有MC38、LLC1细胞系)与不发生远端效应肿瘤的各方面差异,发现未发生远端效应的肿瘤CD8+T细胞浸润明显偏少,且由CAFs调控的细胞外基质重塑显著上调;再借助CRISPR筛选,研究者们发现表达SFRP2的CAFs(下文简称SFRP2HighCAFs)作用最为关键,敲除SFRP2即可激活CD8+T细胞介导的抗肿瘤免疫应答,远端效应也就回来了。
接下来通过细胞相互作用分析,研究者们发现可能受SFRP2HighCAFs调控的是血管内皮细胞和巨噬细胞,前者出现了新生血管形成通路表达富集,后者则主要是促癌的M2表型,这都会导致肿瘤微环境免疫抑制;空间定位分析则显示,SFRP2HighCAFs及它调控的细胞主要分布在血管周围,且同一区域内的CD8+T细胞数量明显减少。
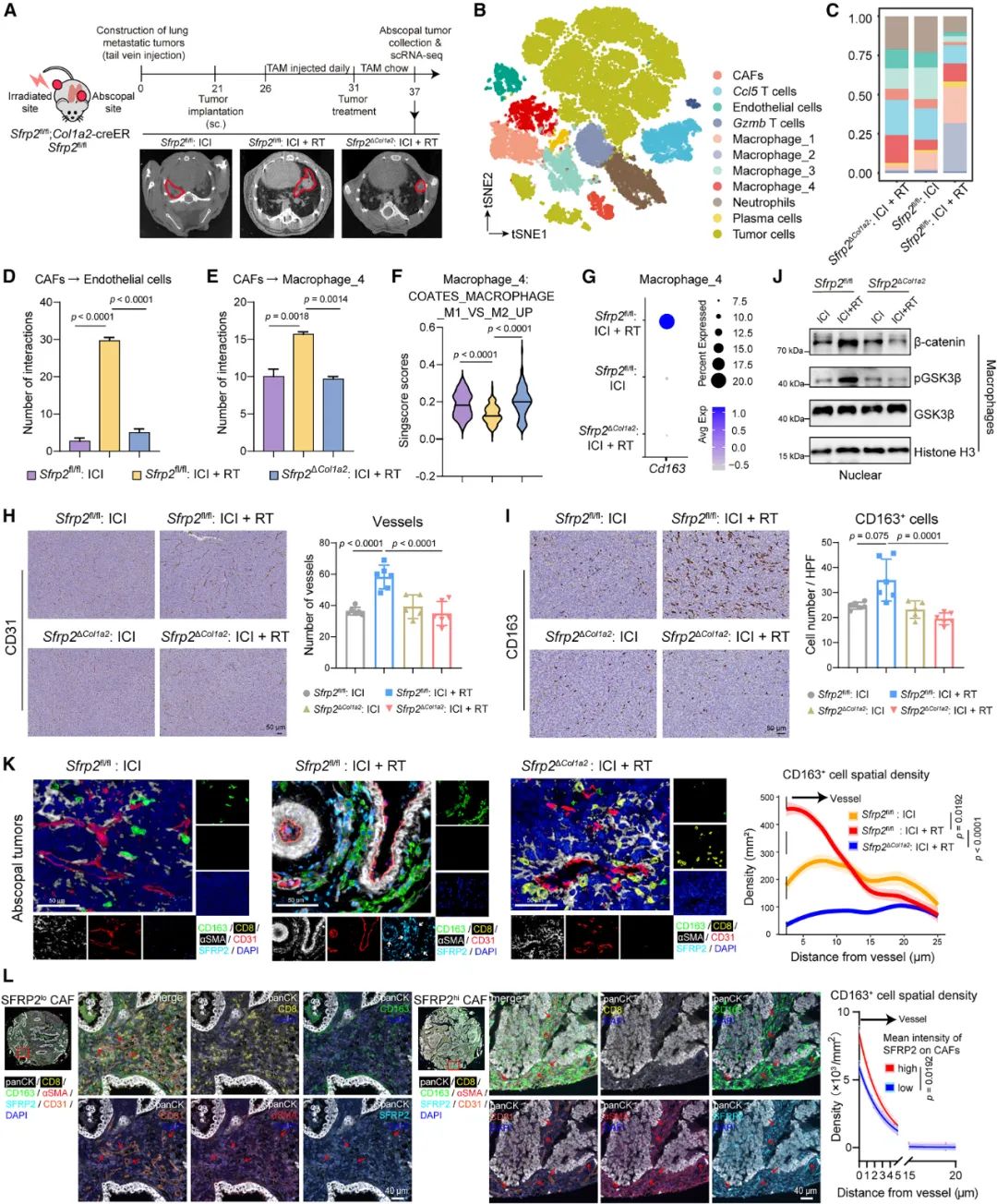
SFRP2HighCAFs可在血管周围影响CD8+T细胞浸润
也就是说,血管周围存在SFRP2HighCAFs和它“帮凶”的区域,是不利于CD8+T细胞浸润和发挥功能的“敌意微环境”;而SFRP2HighCAFs能营造出这种环境主要是靠两种调控机制,首先是抑制内皮细胞表达与细胞黏附相关的15-羟基前列腺素脱氢酶(HPGD),影响CD8+T细胞浸润,其次则是抑制巨噬细胞分泌趋化因子CXCL4对CD8+T细胞的募集。
那么问题来了,制造出SFRP2HighCAFs这个‘“元凶”的又是谁呢?基于对人类肺癌单细胞测序数据库的分析,研究者们认为SFRP2HighCAFs在表型上对应肌成纤维细胞CAFs,而这类CAFs主要起源于周细胞;细胞示踪实验也证实,未经放疗照射肿瘤内的周细胞,确实会在放疗+免疫治疗处理后发生表型转变,变成了SFRP2HighCAFs。
而且,周细胞向SFRP2HighCAFs转化的过程发生在整个故事的开始,当时只有一部分癌症模型小鼠发生了远隔效应,那就说明这部分肿瘤可能在放疗后分泌了某些物质诱导周细胞表型转变,研究者们由此找到了外周血中水平上调的PAI-1,并在实验中证实:PAI-1可与周细胞表面的LRP1受体结合,诱导p65磷酸化和核转位,进而上调SFRP2表达水平,导致SFRP2HighCAFs的出现、阻止远端效应发生,抑制PAI-1即可逆转上述过程。
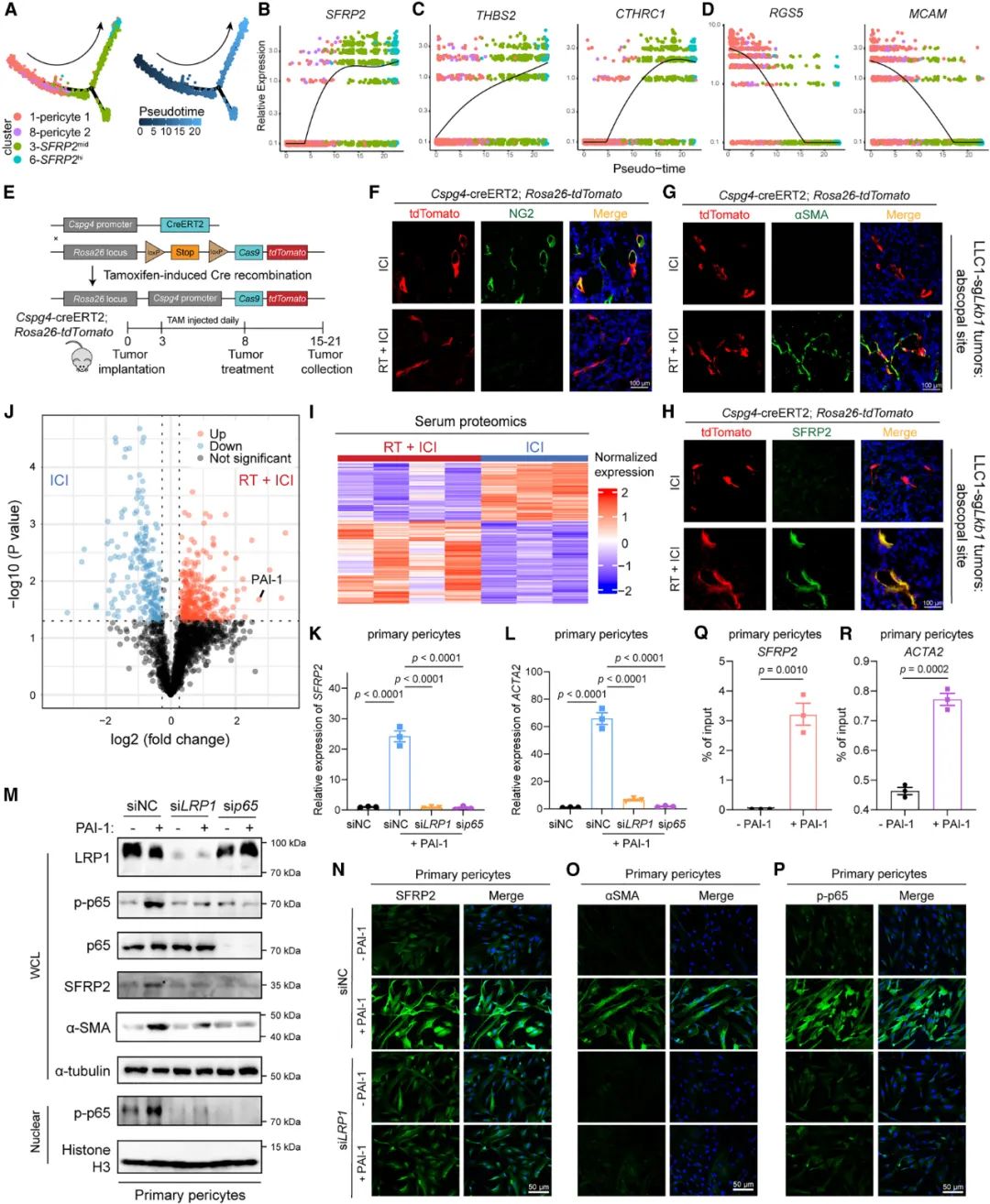
PAI-1可诱导周细胞转化为SFRP2HighCAFs
对人类癌症患者临床数据的分析也证实,放疗后远端效应的出现与SFRP2、PAI-1低表达显著相关,同时TGF-β信号可能在上游诱导PAI-1分泌;而异种移植小鼠实验也显示,用单抗抑制SFRP2或PAI-1可与免疫治疗+放疗协同诱导远端效应,改善治疗对远处病灶的杀伤效果,有望后续向临床应用转化。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


