Mol Cancer: CCL11可能是一种有效的抗癌T细胞增强剂
来源:生物谷原创 2024-03-26 16:29
本研究中,研究者系统地评估了趋化因子融合的hpv16e6 /E7抗原在体内改善核苷酸疫苗诱导的细胞和体液免疫反应。
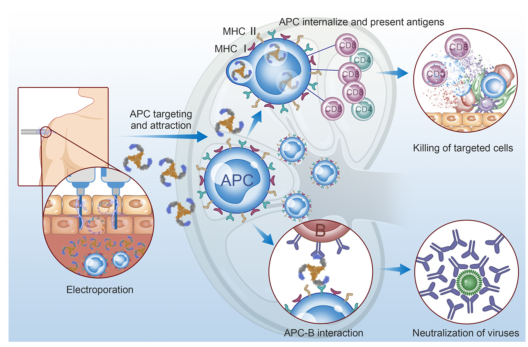
由mRNA或DNA抗原前体组成的核苷酸疫苗被宿主细胞吸收,其核苷酸序列在细胞内被翻译成抗原。然后,这些抗原可以被细胞质中的蛋白酶体降解,生成MHC-I分子的表位肽,并激活细胞毒性反应。细胞外分泌的抗原被抗原呈递细胞(APCs)吞噬,同时触发T辅助细胞或体液免疫。
核苷酸疫苗的特性赋予它们不仅在预防方面而且在治疗方面治疗癌症等疾病的能力。个体化RNA突变体疫苗成功地免疫了黑色素瘤患者,产生了良好的t细胞应答,延长了无进展生存期。核酸疫苗的免疫原性是成功的关键。因此,进一步的改进是非常可取的。

图片来源:https://doi.org/10.1186/s12943-024-01958-4
近日,来自中国医学科学院药物生物技术研究所的研究者们在Mol Cancer杂志上发表了题为“Genetic fusion of CCL11 to antigens enhances antigenicity in nucleic acid vaccines and eradicates tumor mass through optimizing T-cell response”的文章,该研究表明CCL11可能是一种有效的抗癌T细胞增强剂。
核酸疫苗在治疗癌症方面显示出良好的效力和功效,具有强大和特异性的T细胞反应。改善递送抗原的免疫原性有助于延长治疗疗效并降低剂量依赖性毒性。
在这里,研究者系统地评估了趋化因子融合的hpv16e6 /E7抗原在体内改善核苷酸疫苗诱导的细胞和体液免疫反应。研究发现,与不同趋化因子的融合改变了针对抗原的免疫反应的性质。虽然许多趋化因子能够单独或同时放大特定的CD8 + T细胞或体液反应,CCL11被认为是改善免疫原性、促进特异性CD8 + T细胞干细胞性和产生肿瘤排斥反应的最有效的趋化因子。
将CCL11与E6/E7抗原融合作为治疗性DNA疫苗显著提高了治疗效果,并在92%的携带肿瘤的小鼠中根除了已建立的大肿瘤(n = 25)。与CCL11融合的抗原扩大了特异性T细胞的TCR多样性,诱导活化的特异性T细胞、中性粒细胞、巨噬细胞和树突状细胞(dc)向肿瘤浸润,形成对肿瘤致命的综合免疫微环境。DNA疫苗联合抗CTLA4治疗进一步增强了治疗效果。此外,CCL11还可用于mRNA疫苗设计。
不同的趋化因子可以形成抗原诱导的免疫类型
图片来源:https://doi.org/10.1186/s12943-024-01958-4
总之,本研究表明与CCL11融合抗原不仅增加了特异性CD8 + T细胞的数量,而且提高了T细胞的质量,表现为TCF1 + PD1- CD62L +干细胞样CD8 + T细胞的数量和克隆多样性的增加。同时,在肿瘤中诱导了一个由先天免疫细胞和特异性免疫细胞组成的肿瘤致死性微环境。机制研究表明,CCR3 +细胞参与了这些免疫增强作用。虽然需要进一步鉴定特定的CCR3 +亚群,但它也表明,有效的抗肿瘤疫苗需要多种细胞亚群的参与。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


