《细胞》子刊:中科院联合郑大破解肠道神经促进肠癌形成的机制
来源:奇点糕 2022-07-05 09:12
结直肠癌是全球癌症相关死亡的第二大原因,每年新发190万人,死亡93万人,其中绝大多数死于复发和转移[1]。
结直肠癌是全球癌症相关死亡的第二大原因,每年新发190万人,死亡93万人,其中绝大多数死于复发和转移[1]。肿瘤干细胞是肿瘤组织中一小部分具有自我更新和分化能力的细胞,能形成肿瘤并使肿瘤产生异质性,是结直肠癌耐药、复发和转移的罪魁祸首。
人体肠道富含神经元,多达6亿个神经元构成肠道的神经系统[2],通过分泌神经递质调节肠道行为。在肠道肿瘤中,肠道神经元作为肿瘤微环境的一部分,参与肠道肿瘤的发生发展。然而,关于肠道神经调控肠道肿瘤的详细机制,尚缺乏清晰研究。
近日,中国科学院大学范祖森教授和田勇教授,联合郑州大学朱平平教授,发现经肠道菌群代谢产物异戊酸刺激后,肠道神经元产生神经递质5-羟色胺,促进结直肠癌干细胞的自我更新,导致肿瘤形成。相关论文发表在神经科学顶级杂志Neuron上[3]。

论文首页截图
首先,研究人员使用神经递质处理结直肠癌干细胞,在体外探索肠道神经递质对结直肠癌干细胞的作用,发现在众多递质中,5-羟色胺能显著促进结直肠癌干细胞形成克隆,并且递质浓度越高,结直肠癌干细胞形成的克隆越大。
随后,研究人员在动物体内进行了实验验证。结直肠癌小鼠经5-羟色胺合成抑制剂处理后,瘤体体积缩小,结直肠癌干细胞比例降低。这提示,5-羟色胺能促进结直肠癌干细胞的自我更新和肿瘤生成。
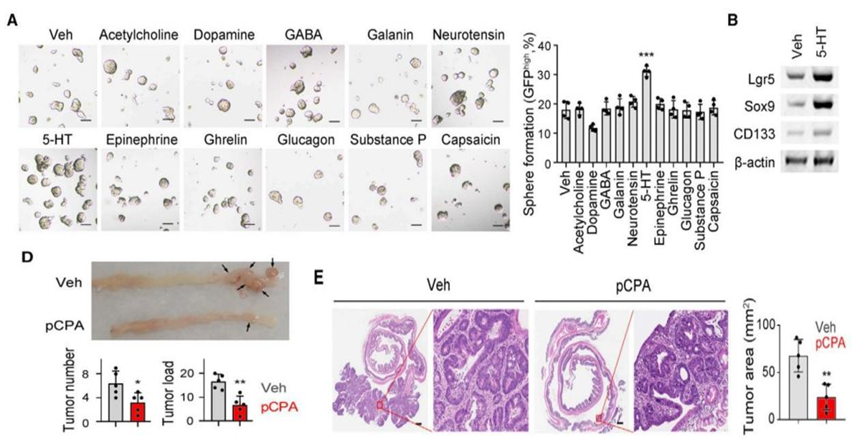
图A:11种神经递质对结直肠癌干细胞克隆形成实验的影响(Veh为空白对照);图B:5-羟色胺(5-HT)处理对结直肠癌干细胞干性标志物(Lgr5)表达的影响;5-羟色胺合成抑制剂(pCPA)处理对结直肠癌瘤体(图D)和结直肠癌干细胞比例(图E)的影响
结直肠癌干细胞表达的5-羟色胺受体多达14种,5-羟色胺是通过结合哪种受体来发挥作用的呢?
研究人员在体外依次沉默每种受体,发现只有敲除受体HTR1B、HTR1D和HTR1F能显著降低结直肠癌干细胞的增殖。另外,相比于其他受体,这三种受体也在结直肠癌瘤体和肿瘤干细胞中高度表达。
随后,研究人员进行小鼠体内成瘤实验,发现荷瘤小鼠在敲除HTR1B/1D/1F后,结直肠肿瘤数目减少,瘤体内的肿瘤干细胞比例也降低。敲除这三种受体,或者使用抑制剂抑制它们,即使再给予5-羟色胺刺激,也不能促进结直肠癌干细胞形成克隆。这些结果表明,5-羟色胺是通过受体HTR1B、HTR1D和HTR1F来促进结直肠癌干细胞增殖。
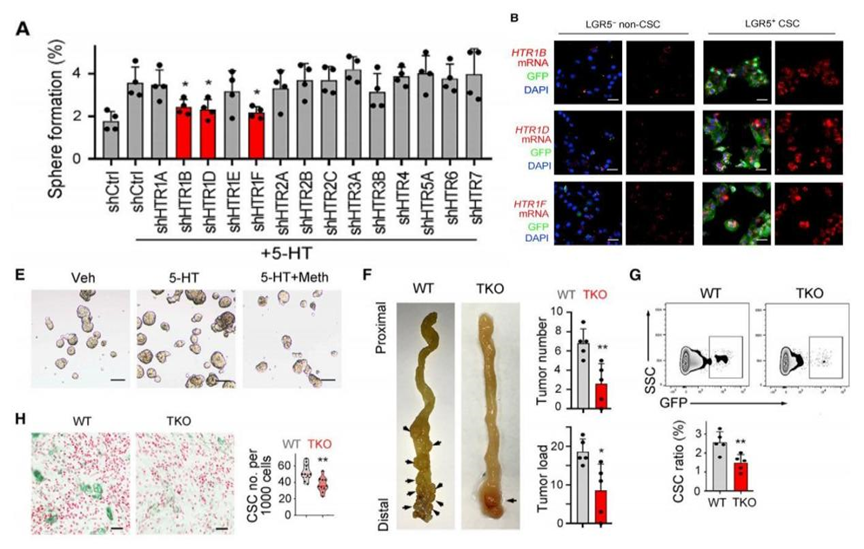
图A:依次敲除5-羟色胺的每种受体检测其对结直肠癌干细胞增殖能力的影响;图B:5-羟色胺受体HTR1B、HTR1D和HTR1F在结直肠癌肿瘤干细胞(LGR5 GFP+)中高表达;使用HTR1抑制剂Meth(图E),或敲除HTR1B/1D/1F(图H),抑制结直肠癌肿瘤干细胞增殖(图G),减轻肿瘤负荷(图F)
接着,研究人员检测了5-羟色胺处理后,结直肠癌干细胞胞内信号通路的变化,发现Wnt/β-连环蛋白信号被显著激活。5-羟色胺刺激后,结直肠癌干细胞β-连环蛋白浓度升高,HTR1B/1D/1F敲除后,β-连环蛋白浓度降低。这表明,5-羟色胺通过HTR1B/1D/1F激活结直肠癌干细胞的Wnt/β-连环蛋白信号通路。
Wnt/β-连环蛋白是促进肿瘤干细胞增殖和维持干性的关键通路,其中,β-连环蛋白是通路的核心成分,由细胞质进入细胞核,激活cylinD1和c-myc等原癌基因促进细胞增殖[4]。当通路未激活时,β-连环蛋白结合axin后被降解,使β-连环蛋白保持在较低水平;而当通路激活时,β-连环蛋白与axin的结合被阻断,β-连环蛋白的降解被抑制,提升β-连环蛋白的浓度。
通过质谱分析,研究人员发现,HTR1B/1D/1F能直接结合axin。HTR1B/1D/1F经5-羟色胺激动后,结合axin1使其发生转位,进而抑制axin结合β-连环蛋白,避免β-连环蛋白降解,从而促进结直肠癌干细胞的增殖。
在肠道内,5-羟色胺由肠嗜铬细胞和血清素能神经元产生。那么,在结直肠癌中,促进结直肠癌干细胞自我更新的5-羟色胺,是由哪种细胞分泌的呢?
肠嗜铬细胞表达5-羟色胺合成的限速酶Tph1,而血清素能神经元以限速酶Tph2为标志物。研究人员检测了结直肠癌中Tph1和Tph2的表达水平,发现只有Tph2在结直肠肿瘤中表达上调,与瘤内5-羟色胺水平呈正相关。
分别敲除结直肠癌小鼠的Tph1和Tph2,研究人员发现,只有Tph2敲除鼠肿瘤减小,肿瘤内5-羟色胺水平降低,结直肠癌干细胞数目减少,增殖能力减弱。这表明在结直肠癌发病中,作用于癌干细胞的5-羟色胺是由血清素能神经元产生。因此,血清素能神经元是结直肠癌干细胞自我更新和结直肠肿瘤发生的必要条件。
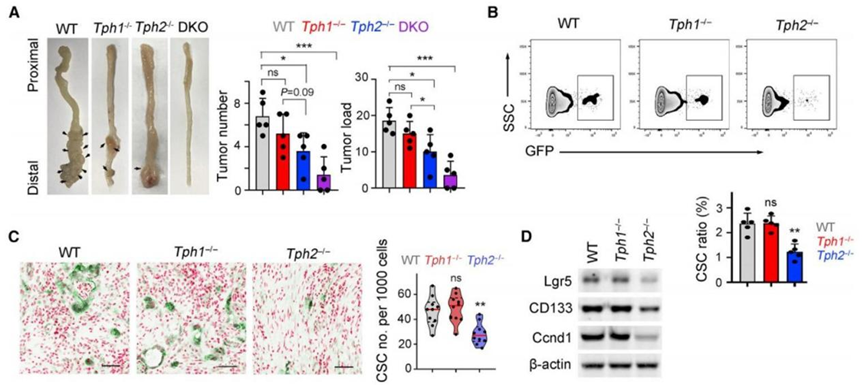
图A:小鼠成瘤实验显示Tph2敲除鼠,而不是Tph1敲除鼠,肿瘤减小;图B、C和D:Tph2敲除鼠结直肠癌干细胞数目减少,增殖能力减弱
然而,在肠道内,又是什么促进血清素能神经元分泌5-羟色胺,从而刺激结直肠癌干细胞增殖的呢?
由于肠道细胞暴露在数量惊人、种类繁多的肠道菌群中,肠道菌群通过神经、代谢和免疫等途径影响肠道健康,与肠道肿瘤的发生发展密切有关[5]。因此,研究人员把目光聚焦在肠道菌群上。
把结直肠癌小鼠的肠道菌群移植给正常小鼠后,研究人员发现正常小鼠的Tph2的表达也随之上调。这提示,结直肠癌相关的菌群可能通过某种方式促进了Tph2的表达。
短链脂肪酸是肠道菌群最重要的代谢物之一,具有神经活性,能调节肠道神经元[6]。研究人员检测到一种短链脂肪酸,异戊酸(IVA),能显著促进Tph2在血清素能神经元中的表达。荧光素酶实验验证了异戊酸对Tph2启动子的激活作用。
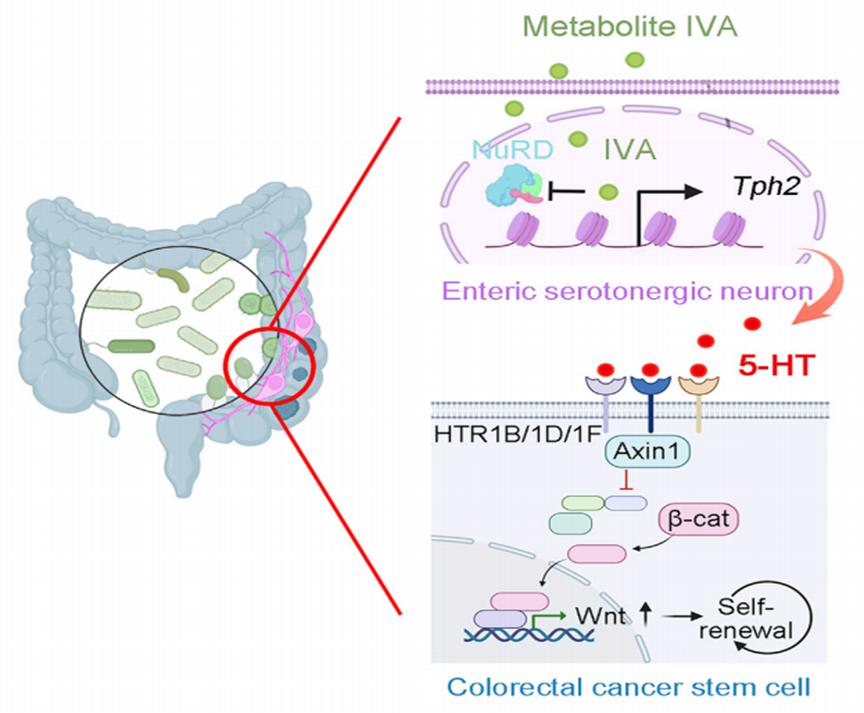
本研究机制示意图
总的来说,肠道菌群代谢产生异戊酸,异戊酸激活肠道血清素能神经元Tph2基因的启动子,上调Tph2的表达,Tph2促进神经元生成5-羟色胺,5-羟色胺与结直肠癌干细胞表面的受体HTR1B/1D/1F结合,HTR1B/1D/1F激动后在胞内结合axin1使其发生转位,进而抑制β-连环蛋白与axin的结合,避免β-连环蛋白降解,从而促进结直肠癌干细胞的自我更新和肿瘤的发生。
参考文献
[1] Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71(3):209-249. doi:10.3322/caac.21660
[2] Drokhlyansky E, Smillie CS, Van Wittenberghe N, et al. The Human and Mouse Enteric Nervous System at Single-Cell Resolution. Cell. 2020;182(6):1606-1622.e23. doi:10.1016/j.cell.2020.08.003
[3] Zhu P, Lu T, Chen Z, et al. 5-hydroxytryptamine produced by enteric serotonergic neurons initiates colorectal cancer stem cell self-renewal and tumorigenesis [published online ahead of print, 2022 May 7]. Neuron. 2022;S0896-6273(22)00369-5. doi:10.1016/j.neuron.2022.04.024
[4] Bian J, Dannappel M, Wan C, Firestein R. Transcriptional Regulation of Wnt/β-连环蛋白 Pathway in Colorectal Cancer. Cells. 2020;9(9):2125. Published 2020 Sep 19. doi:10.3390/cells9092125
[5] Fan Y, Pedersen O. Gut microbiota in human metabolic health and disease. Nat Rev Microbiol. 2021;19(1):55-71. doi:10.1038/s41579-020-0433-9
[6] Silva YP, Bernardi A, Frozza RL. The Role of Short-Chain Fatty Acids From Gut Microbiota in Gut-Brain Communication. Front Endocrinol (Lausanne). 2020;11:25. Published 2020 Jan 31. doi:10.3389/fendo.2020.00025
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


