CD:活性提升1000倍!新一代高选择性ROS1抑制剂来了
来源:奇点糕 2023-03-10 09:19
他们通过一系列临床前实验显示,NVL-520对多种ROS1融合及其耐药性突变均有效,抑制效力可达到目前临床使用ROS1抑制剂的10-1000倍,并能穿透血脑屏障发挥药效。
ROS1是受体型酪氨酸激酶(RTK)家族成员之一,在80年代被首次发现。随后的大量研究表明ROS1在多种癌症中发挥重要作用,因此,近年来其作为肿瘤治疗药物的分子靶点受到了越来越多的关注。
肺癌是我国的第一大癌,其中非小细胞肺癌(NSCLC)占比约80%。在NSCLC中,大约1-3%的患者会发生ROS1基因融合。
目前,已有多个获批上市的酪氨酸激酶抑制剂(TKI)可用于治疗ROS1融合阳性的晚期NSCLC患者。但在治疗过程中却发现已有TKI或多或少存在不尽如人意的缺点。比如,出现获得性耐药;药物具有多重靶点,对ROS1的选择性不够好;还有的药物很难穿过血脑屏障,对脑转移的治疗或预防效果不好等等。
鉴于以上原因,需要开发更优的ROS1靶点药物以满足临床治疗需求。也正是在这样的背景下,新一代ROS1抑制剂NVL-520应运而生。
最近,NVL-520的研发团队在国际顶尖肿瘤学期刊Cancer Discovery发表最新研究成果[1]。他们通过一系列临床前实验显示,NVL-520对多种ROS1融合及其耐药性突变均有效,抑制效力可达到目前临床使用ROS1抑制剂的10-1000倍,并能穿透血脑屏障发挥药效。
此外,NVL-520对ROS1选择性远远大于其他结构与ROS1类似的激酶(可达50倍以上)。更为重要的是,相比对原肌球蛋白相关激酶(TRK)的作用,NVL-520对ROS1融合及其耐药性突变的抑制作用可达到前者的数百倍,极大程度上避免了TRK抑制引起的神经系统相关副作用。

文章首页截图
在了解NVL-520的药理学数据之前,咱们先来认识一下这个分子,以及它与ROS1的结合方式。
NVL-520是一种大环小分子ROS1抑制剂。计算机模拟显示,NVL-520以类似于洛拉替尼(Lorlatinib)的方式结合ROS1[2],主要为NVL-520的氨基吡啶部分与ROS1铰链区的氨基酸残基Glu2027和Met2029形成两个氢键。
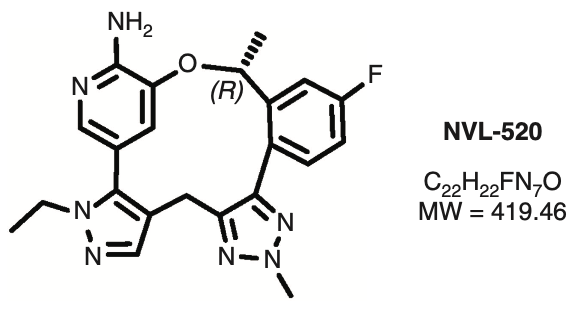
NVL-520的化学结构式和分子量
接下来,我们将从三个方面来介绍NVL-520在临床前研究中的优异表现。
第一个要介绍的是NVL-520对耐药变异的效果。
我们都知道,克唑替尼(Crizotinib)是首个被批准用于治疗ROS1融合阳性NSCLC患者的TKI。虽然最初使用时具有较好的疗效,但随着用药时间的延长很多患者都出现了获得性耐药。耐药发生主要是由于ROS1区域的二次突变[3],其中以CD74-ROS1融合中G2032R突变最为常见。
G2032R突变会在蛋白与抑制剂结合时形成空间位阻,降低抑制剂对蛋白的亲和力,从而影响抑制剂起效[4]。因此,研发团队在设计时让NVL-520上与G2032突变位点相互作用的区域体积尽可能小,以降低蛋白和抑制剂结合时的空间位阻。
通过随后的生物活性评价(激酶和体外肿瘤细胞水平)发现,较低浓度的NVL-520即可有效抑制野生型ROS1和G2032R突变型ROS1的活性,抑制效力可达到目前临床使用的其他ROS1抑制剂的10-1000倍。
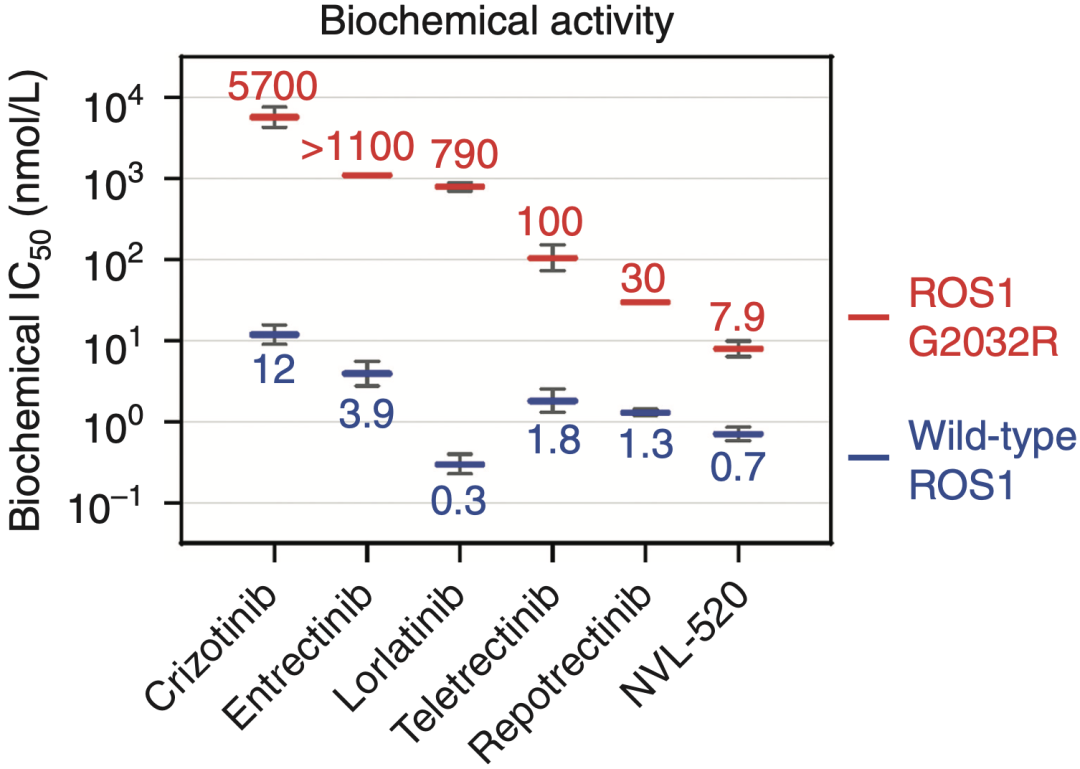
不同ROS1 TKI在激酶水平对ROS1和突变型ROS1的抑制作用
在使用ROS1阳性NSCLC患者来源肿瘤细胞建立的PDX小鼠中,也观察到NVL-520对ROS1 G2032R突变表现出显著的抗肿瘤活性。无论与空白对照组,或其他ROS1抑制剂组相比,使用NVL-520治疗的小鼠肿瘤体积随用药时间的增加明显缩小。
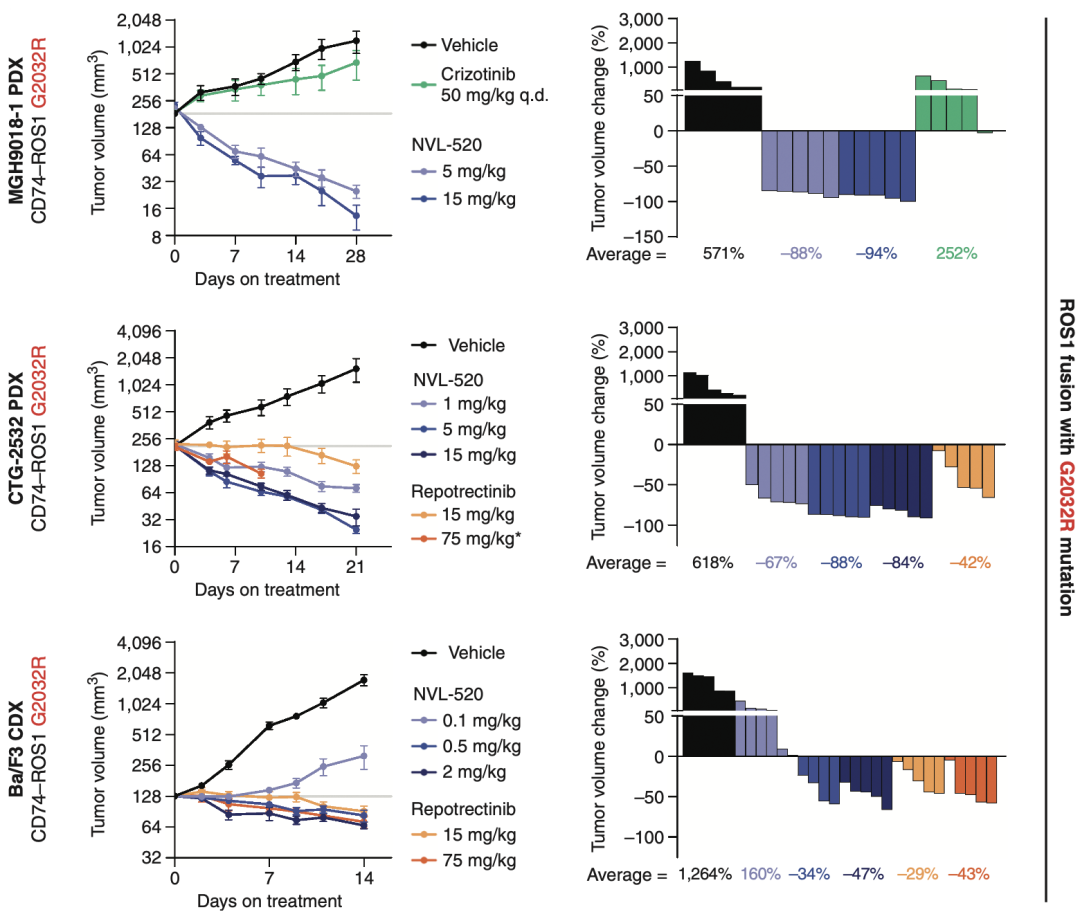
NVL-520在PDX小鼠模型上的抗肿瘤活性
第二个要介绍的是NVL-520对ROS1的选择性。
目前,虽然二代TKI已经可以克服ROS1二次突变引起的耐药,但由于ROS1与其他蛋白激酶结构的相似性,这些药物在抑制ROS1时,还会影响其他激酶的正常功能。而NVL-520对ROS1选择性远远大于其他结构与ROS1类似的激酶(可达50倍以上)。
在ROS1抑制剂对其他激酶的影响中,最为常见的就是由于对TRK的抑制而引起的神经系统相关不良事件,包括认知、情绪、睡眠障碍等。因此,ROS1特异性抑制剂对ROS1的活性和选择性需比对TRK更强。
通过对比ROS1和TRK的结构,研究人员发现,ROS1与TRK的一个位置存在差异,ROS1上的这个位置是一个较小的残基,而TRK的这一位置却是一个较大的酪氨酸残基。
巧的是,NVL-520骨架结构中的吡唑基团正好与TRK上这个较大的残基形成空间位阻,阻碍了NVL-520与TRK的结合,但并不影响NVL-520与ROS1的结合。
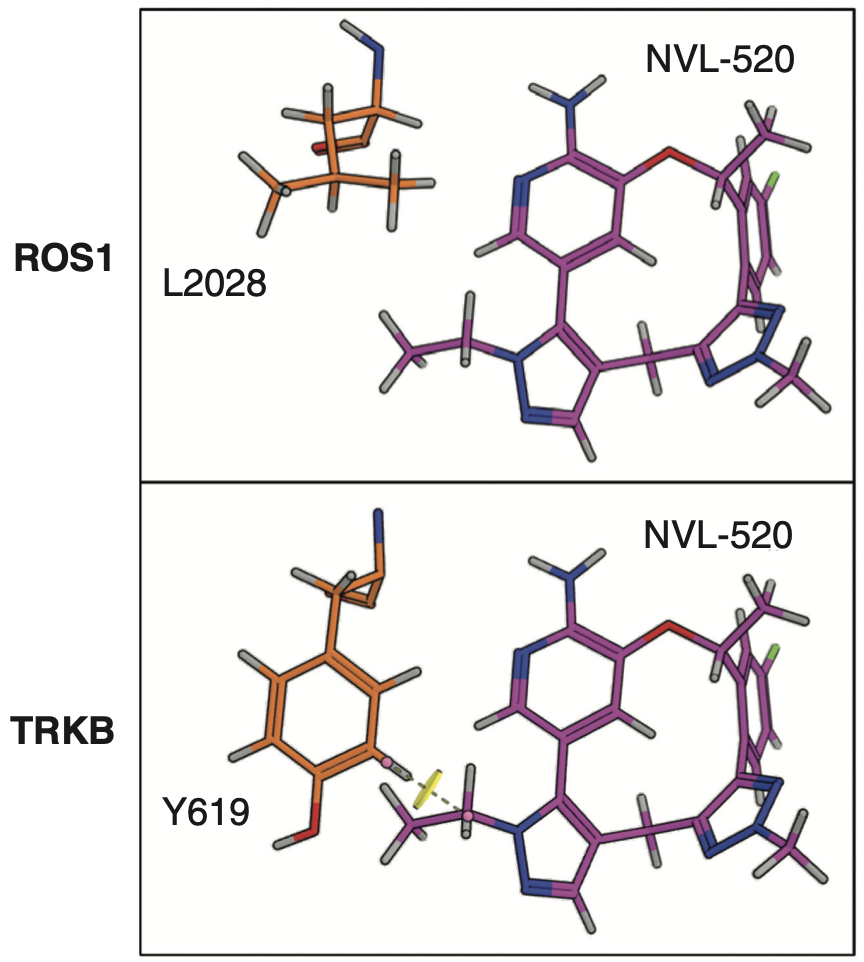
NVL-520与ROS1和TRK(TRKB)结合位点示意图
NVL-520的研究团队还在生化、细胞活力和磷酸化实验中,分析了6个ROS1 TKI对ROS1和TRK的相对抑制效力。结果发现,NVL-520对ROS1的抑制效力可达到其他ROS1抑制剂的数百倍。
以细胞磷酸化检测为例,他们将TRK与ROS1(野生型或G2032R)的IC50比率定义为“选择性窗口”。选择性窗口值>1表示对ROS1的效力高于TRK,而选择性窗口值<1表示对TRK的效力高于ROS1。
NVL-520对野生型ROS1和G2032突变型ROS1的“选择性窗口”值分别达到670倍和240倍,说明NVL-520对ROS1的活性和选择性均远比对TRK更强。而其他ROS1抑制剂的表现均差强人意,即使洛拉替尼(Lorlatinib)对野生型ROS1表现出较好的选择性(600倍),但它对G2032突变型ROS1的选择性也并不好(2.3倍)。
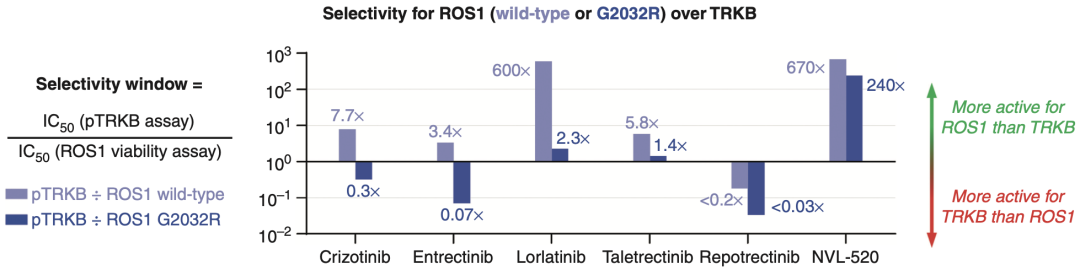
细胞磷酸化检测中不同ROS1抑制剂对ROS1和TRK的“选择性窗口”值
第三个是NVL-520的脑内抗肿瘤活性。
由于20-40%的ROS1融合阳性的NSCLC患者在确诊时往往伴随脑部转移,所以一个理想的ROS1抑制剂应该能有效地穿过血脑屏障,以便对脑内转移灶发挥药效。
研究团队对NVL-520的入脑能力进行了评估。他们向小鼠脑内注射了经过改造的小鼠Ba/F3细胞(带有荧光并表达人CD74–ROS1 G2032R蛋白),并在注射后16天内通过动物活体荧光成像监测小鼠脑内肿瘤的生长情况。
在观察期内,所有对照组小鼠脑内肿瘤快速生长,中位生存期仅为16.5天。而剂量为2mg/kg的NVL-520有效抑制了肿瘤生长,治疗组小鼠均存活至实验终止(中位生存期>61天)。相比对照组,NVL-520的治疗将小鼠的生存时间延长了4倍以上,表明NVL-520具有良好的脑内抗肿瘤活性。
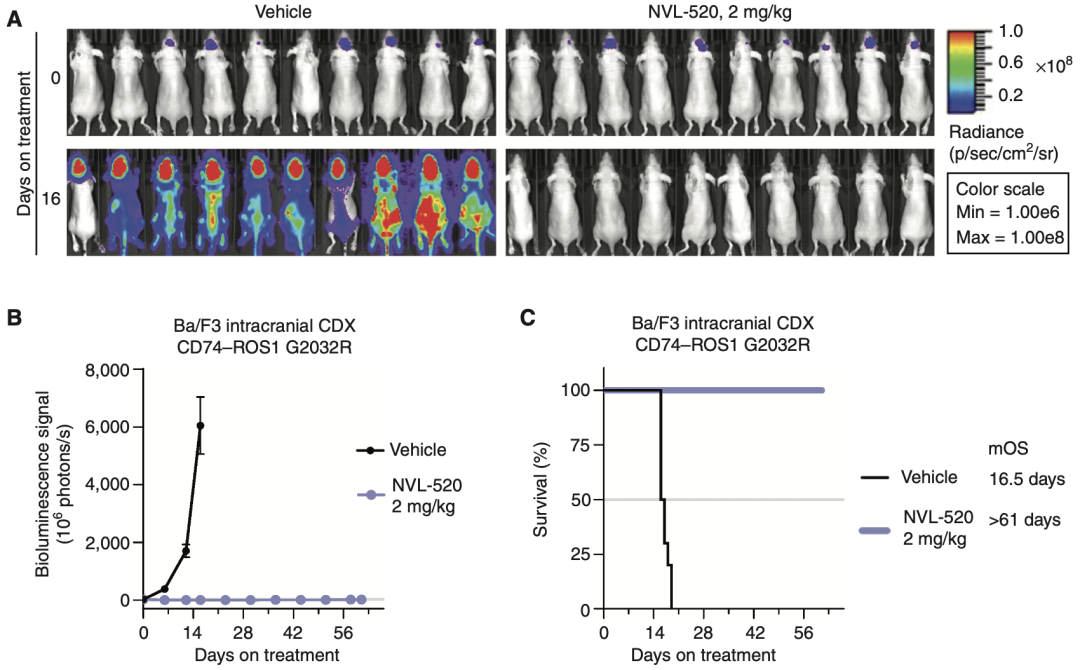
NVL-520在小鼠脑内的抗肿瘤活性
此外,本研究还报告了3个ROS1融合阳性肺癌患者的病例研究。这些患者或携带ROS1 G2032R突变,或出现脑转移,并在一系列ROS1 TKI治疗后复发或难以治疗。在使用NVL-520治疗后,病情均得到不同程度的缓解,并且未发现与神经系统相关副作用。
如病例1为转移性肺腺癌患者,经多药治疗后出现耐药,检出CD74-ROS1融合伴ROS1 G2032R突变,NVL-520治疗4周后成像结果显示双侧肺多个转移灶已变小。病例2为携带EZR–ROS1融合伴ROS1 G2032R突变的NSCLC和多发性脑转移患者,NVL-520治疗4周后也观察到右枕叶内转移灶消退。
总结来说,NVL-520是一个新型高效ROS1抑制剂,不仅可以克服由ROS1二次突变导致的耐药,并具有较好的血脑屏障穿透能力,同时对ROS1具有更好的选择性以避免ROS1/TRK双抑制剂所引起的神经系统不良反应。
目前,NVL-520用于晚期ROS1阳性NSCLC和其他实体瘤患者的ARROS-1 1/2期临床试验正在进行,已获得的数据初步显示NVL-520具有较好的安全性和耐受性,并对经过大量前期治疗的ROS1阳性NSCLC患者(包括脑转移)有效,有望在未来成为ROS1阳性癌症患者的新选择。
参考文献:
1.A Drilon, JC Horan, A Tangpeerachaikul, et al. NVL-520 Is a Selective, TRK-Sparing, and Brain-Penetrant Inhibitor of ROS1 Fusions and Secondary Resistance Mutations[J]. Cancer Discov. 2023, 13(3):598-615.
2.HY Zou, Q Li, LD Engstrom, et al. PF-06463922 is a potent and selective next-generation ROS1/ALK inhibitor capable of blocking crizotinib-resistant ROS1 mutations[J]. Proc Natl Acad Sci U S A. 2015, 112(11):3493-8.
3.JJ Lin, NJ Choudhury, S Yoda, et al. Spectrum of mechanisms of resistance to crizotinib and lorlatinib in ROS1 fusion-positive lung cancer[J]. Clin Cancer Res. 2021, 27(10):2899-2909.
MM Awad, R Katayama, M McTigue, et al. Acquired resistance to crizotinib from a mutation in CD74-ROS1[J]. 2013, 368(25):2395-401.
4.MM Awad, R Katayama, M McTigue, et al. Acquired resistance to crizotinib from a mutation in CD74-ROS1[J]. 2013, 368(25):2395-401.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


