《自然》双重磅:最新研究证实,前列腺素E2竟是抑制肿瘤内T细胞扩增的促癌大反派!
来源:奇点糕 2024-04-29 14:05
TMU团队与瑞士学者合作开展的研究,进一步补全了IL-2Rγc表达下调后,TCF1+CD8+T细胞无法被成功激活的证据链。
由德国和瑞士学者发表的两篇最新研究论文显示,前列腺素中的前列腺素E2(PGE2),是抑制CD8+T细胞响应白介素-2(IL-2)信号,导致干细胞样CD8+T细胞和浸润到肿瘤内的CD8+T细胞数量无法扩增,乃至因线粒体功能异常、最终发生细胞铁死亡的关键,因此针对PGE2及其受体EP2/EP4信号轴进行干预,有望为免疫治疗提供全新助力[1-2]。
其实细说起来,这次登上《自然》的两篇研究成果还真像是连续剧,比如发表第一篇论文的德国慕尼黑工业大学(TMU)团队,在去年于《癌细胞》上发表过一项前列腺素参与调节CD8+T细胞激活状态的研究,奇点糕们当时就做过介绍;而第二篇论文也是TMU团队与瑞士洛桑大学团队紧密合作,从不同角度破解谜题的成果。

TMU团队论文首页截图
本来既往就有很多研究显示,PGE2信号对T细胞的生物学行为和免疫功能有重要影响,并可能参与调控免疫逃逸[3-4],再加上TMU团队的长期“追凶”,不继续深入研究都不合适。在第一篇论文中,TMU团队把探索重点放在了干细胞样CD8+T细胞,即TCF1+CD8+T细胞身上,评估PGE2信号对它们的影响。
实验显示,经基因敲除使CD8+T细胞缺少EP2/EP4两种PGE2受体后,小鼠免疫系统对植入肿瘤的抑制能力显著增强,抑癌效应主要由浸润大幅增多的CD8+T细胞(即CD8+TILs)介导,且抑制PGE2信号的影响仅限于肿瘤局部,并不会通过影响树突状细胞(DCs)调节T细胞致敏(T Cell Priming),而是使瘤内的CD8+T细胞大量扩增并向效应亚群分化。
大量扩增的CD8+T细胞源头,正是前面提到的TCF1+CD8+干细胞样T细胞,它们甚至可以说是小鼠免疫系统抑癌必不可少的“火种”。而PGE2-EP2/EP4信号正常存在时,TCF1+CD8+T细胞的增殖和向效应表型分化都会受到明显抑制,这是因为PGE2信号直接下调了TCF1+CD8+T细胞表面IL-2受体γ链(IL-2Rγc)的表达水平,使IL-2即使数量正常乃至大量存在,也无法有效激活TCF1+CD8+T细胞,没有激活也就没有免疫可言了。
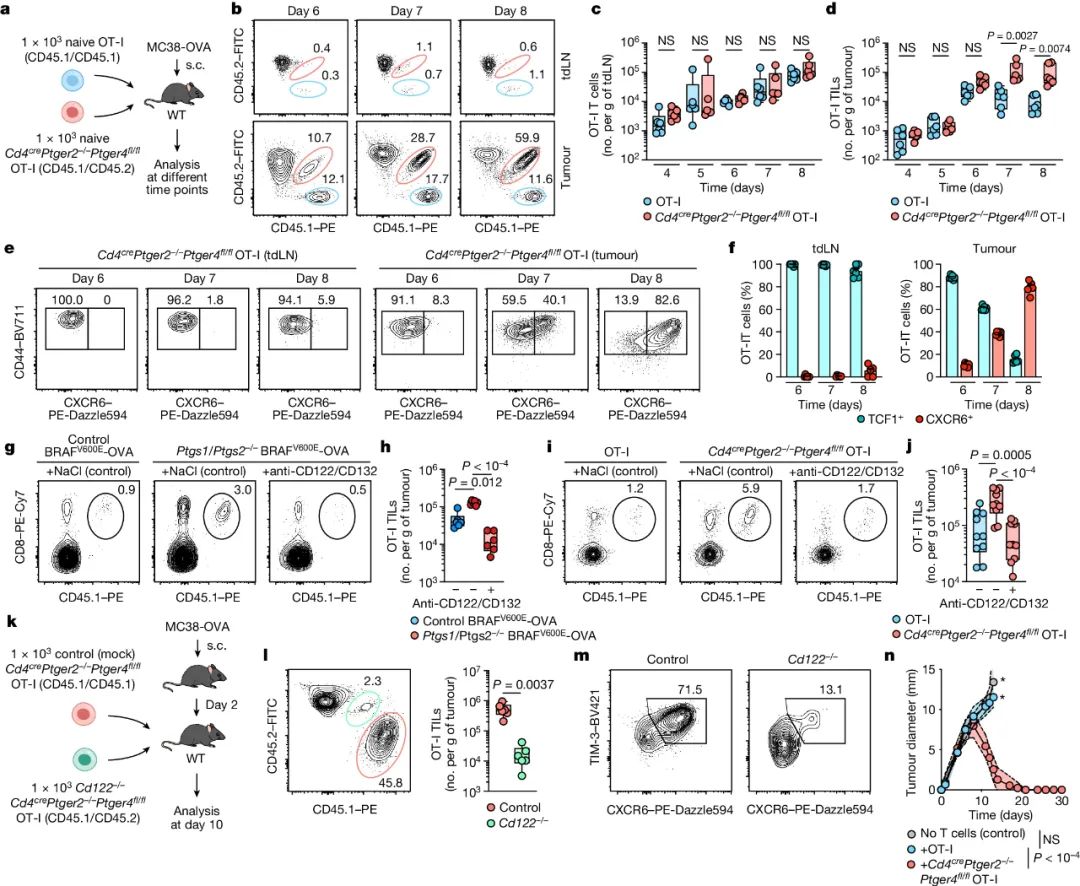
PGE2-EP2/EP4信号会抑制TCF1+CD8+T细胞对IL-2的响应
而TMU团队与瑞士学者合作开展的研究,则进一步补全了IL-2Rγc表达下调后,TCF1+CD8+T细胞无法被成功激活的证据链:向源自人类肿瘤组织的CD8+TILs外源性补充PGE2后,PGE2会介导钙离子涌入细胞内,导致IL-2Rγc快速被降解,IL-2Rγc与IL-2受体β链(IL-2Rβ)也就无法在细胞表面正常形成受体复合物。
于是,IL-2信号就无法激活CD8+TILs内本应响应的AKT–mTOR–S6信号,这会使CD8+TILs发生代谢重编程,如脂质过氧化(lipid peroxidation)相关基因表达被显著上调,且线粒体会发生明显的功能异常,即氧化应激显著增强、核苷酸合成明显减少,在这一过程中发挥关键影响的是受mTOR调控的转录因子PGC1α,它的活性会被PGE2直接抑制。
如果CD8+TILs的线粒体功能异常和脂质过氧化状态长期持续,最终就会进展到细胞铁死亡(ferroptosis)的发生,所以PGE2-EP2/EP4信号的罪名不只是打压CD8+TILs了,这是要把它们给直接逼死啊。最后研究者们还专门证实,抑制PGE2-EP2/EP4信号能显著改善CD8+TILs过继性细胞疗法(ACT)的各方面表现,估计免疫检查点抑制剂(ICIs)疗法也有可能按同样的逻辑获益,这就非常值得在未来设计专门的疗法了。
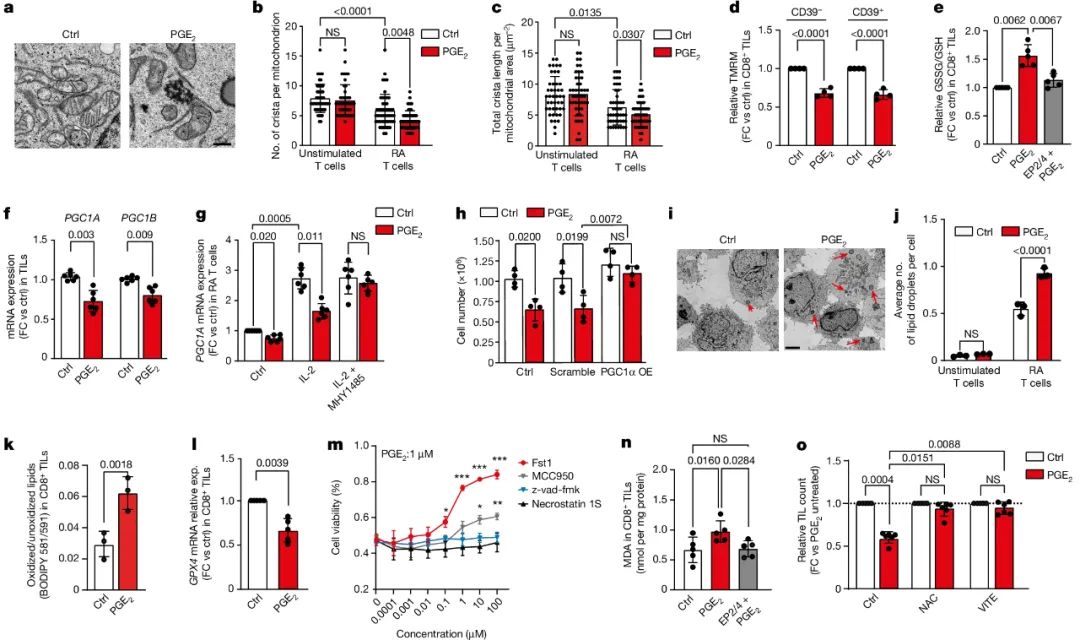
PGE2信号可导致CD8+TILs发生细胞铁死亡
参考文献:
[1]Lacher S B, Dörr J, De Almeida G P, et al. PGE2 limits effector expansion of tumour-infiltrating stem-like CD8+ T cells[J]. Nature, 2024.
[2]Morotti M, Grimm A J, Hope H C, et al. PGE2 inhibits TIL expansion by disrupting IL-2 signalling and mitochondrial function[J]. Nature, 2024.
[3]Chen J H, Perry C J, Tsui Y C, et al. Prostaglandin E2 and programmed cell death 1 signaling coordinately impair CTL function and survival during chronic viral infection[J]. Nature Medicine, 2015, 21(4): 327-334.
[4]Böttcher J P, Bonavita E, Chakravarty P, et al. NK cells stimulate recruitment of cDC1 into the tumor microenvironment promoting cancer immune control[J]. Cell, 2018, 172(5): 1022-1037. e14.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


