Cancer Cell:甘波谊团队首次发现放疗会诱导癌细胞铜死亡,提出破解癌症放疗抵抗新思路
来源:生物世界 2025-04-12 14:52
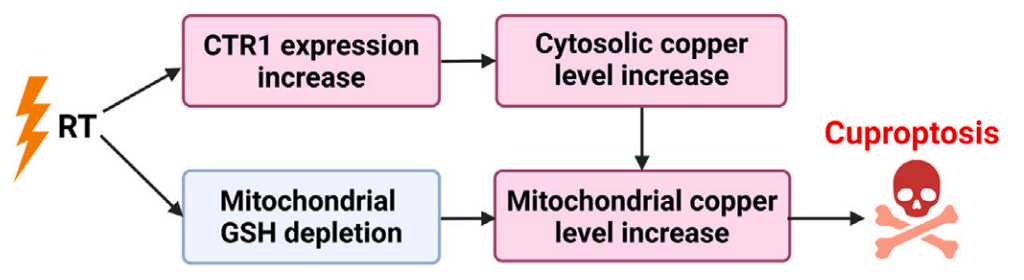
该研究首次发现放疗通过激活铜死亡杀伤癌细胞,并解析了具体机制——放疗通过上调铜转运蛋白-1 (CTR1)以及消耗线粒体中铜螯合蛋白谷胱甘肽(GSH)来提高线粒体中的铜水平,从而引发铜死亡。
MD 安德森癌症中心甘波谊教授团队(雷光博士、孙明闯博士和程军博士为共同第一作者)在 Cancer Cell 期刊发表了题为:Radiotherapy promotes cuproptosis and synergizes with cuproptosis inducers to overcome tumor radioresistance 的研究论文。
该研究首次发现放疗通过激活铜死亡杀伤癌细胞,并解析了具体机制——放疗通过上调铜转运蛋白-1 (CTR1)以及消耗线粒体中铜螯合蛋白谷胱甘肽(GSH)来提高线粒体中的铜水平,从而引发铜死亡。进而开创性地提出了铜离子载体联合放疗来逆转肿瘤的放疗抵抗,这些发现为破解肿瘤放疗抵抗提供了全新思路。

放疗通过高能辐射破坏癌细胞的 DNA,但狡猾的癌细胞会通过多种途径来抵抗放疗,包括修复 DNA 损伤、激活抗氧化防御、关闭细胞凋亡程序等。传统观点认为,放疗主要造成癌细胞发生凋亡,但越来越多的证据表明,其他细胞死亡形式(例如铁死亡)也参与其中。而这项最新研究首次发现,一种新型死亡方式——铜死亡(Cuproptosis),在放疗疗效中发挥着关键角色。
什么是“铜死亡”?
铜是从细菌和真菌到植物、动物以及人类生命活动的基本元素,作为必需酶的辅助因子,在生命活动中发挥着必不可少的作用。铜在人体中是一种微量元素,细胞内铜离子的浓度通过主动稳态机制保持在非常低的水平,一旦超过阈值,铜就会变得有毒,导致细胞死亡。
2022 年,哈佛-MIT博德研究所 Todd Golub 教授团队在 Science 期刊发表论文。发现并证实铜依赖性受控细胞死亡方式是一种不同于已知细胞死亡机制的新型细胞死亡方式——铜死亡(Cuprotosis)。
铜死亡的触发条件是线粒体内铜离子过量堆积,致死机制是铜离子结合脂酰化蛋白(例如DLAT),破坏线粒体代谢酶,引发“蛋白质灾难”,关键标志是脂酰化蛋白寡聚化、铁硫簇蛋白(FDX1/LIAS)降解。
放疗激活铜死亡
在这项最新研究中,研究团队通过细胞实验、动物模型和癌症患者样本分析,发现放疗通过双重机制引发铜死亡:
1、打开铜吸收通道:通过上调铜转运蛋白 CTR1,促进癌细胞摄取铜离子;
2、解除铜封印:耗竭线粒体谷胱甘肽(天然铜螯合剂),释放蓄积的铜离子;
因此,放疗通过上调铜转运蛋白 CTR1 以及耗竭线粒体谷胱甘肽(GSH),提高线粒体内铜水平,引发铜死亡。
放疗抵抗的根源:铜死亡机制失灵
通过对放疗不敏感的肿瘤进行研究,研究团队发现其中的关键改变——BACH1 蛋白缺失,导致金属硫蛋白 MT1E/X 过度表达,而 MT1E/X 蛋白能够像“海绵吸水”一样结合铜离子,阻止线粒体铜蓄积。这解释了为何部分肿瘤对放疗不敏感——它们进化出了“铜缓冲系统”,面对放疗,难以提高铜水平,因此难以发生铜死亡。
利用铜离子载体破解放疗抵抗
在上述发现的基础上,研究团队提出创新疗法:使用铜离子载体 Elesclomol,促进外源铜离子进入细胞,诱导铜死亡,能够显著增强放疗抵抗的癌细胞,细胞系来源的异种移植瘤,以及患者来源的异种移植瘤对放疗的敏感性,大幅缩小肿瘤体积,显著提高肿瘤小鼠模型生存期。更令人振奋的是,该方法在正常组织中耐受性良好,未出现明显毒副作用。
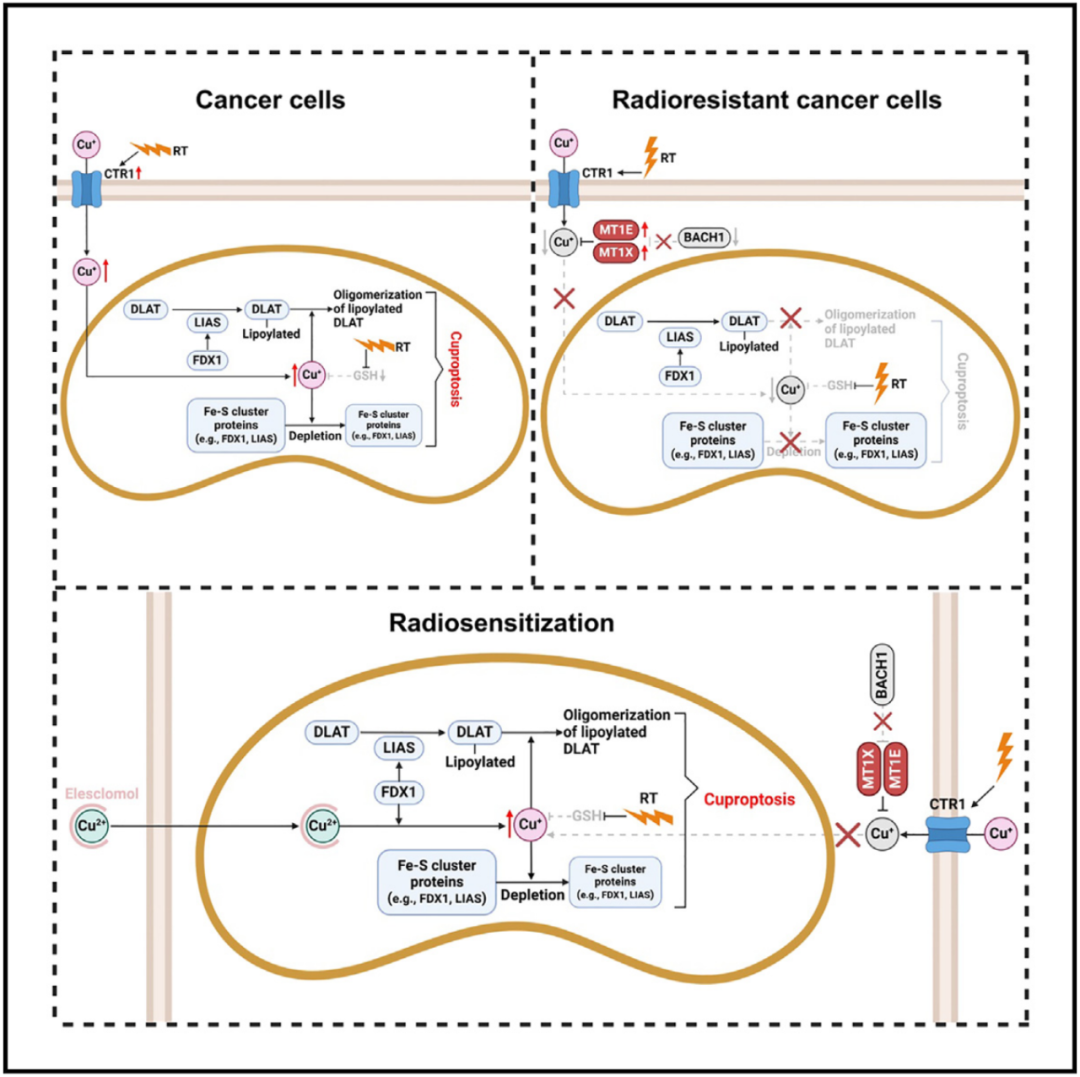
总的来说,这项研究让我们对放疗的抗癌作用有了全新认知,揭示了放疗与铜死亡之间的联系,从而揭示了肿瘤的放疗抵抗的深层原因,并提供了“精准激活铜死亡”的创新疗法,通过靶向铜死亡,破解肿瘤的放疗抵抗,为放疗抵抗的肿瘤治疗提供全新思路。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


