让冷肿瘤变热!路慧丽/姜龙团队开发增效减毒的新一代免疫细胞因子前药
来源:生物世界 2024-05-05 12:19
IL-15是一种非常有吸引力的免疫刺激细胞因子,因其在治疗各种类型的癌症方面的显著活性而闻名。
上海交通大学药学院路慧丽与上海市胸科医院姜龙团队(史文强、刘楠为共同第一作者)合作,在 Cell Reports Medicine 期刊发表了题为:Next-generation anti-PD-L1/IL-15 immunocytokine elicits superior antitumor immunity in cold tumors with minimal toxicity 的研究成果。
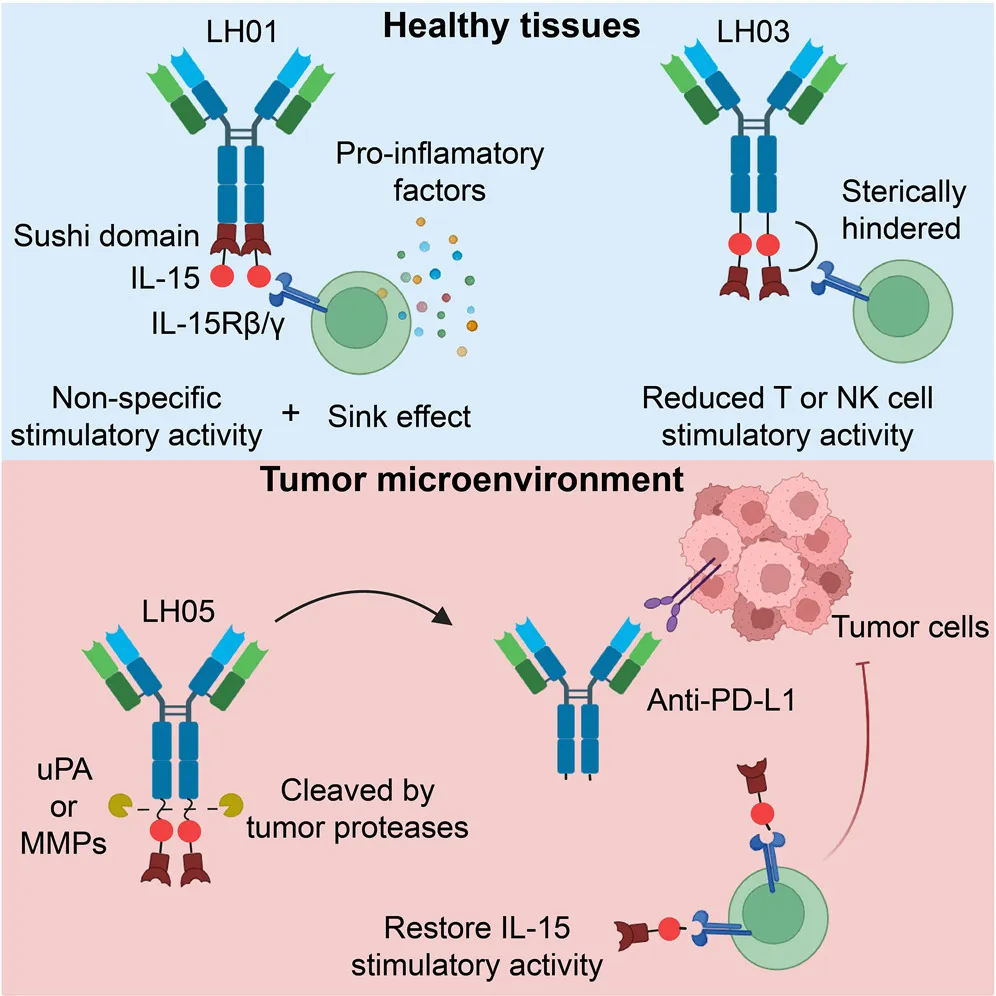
该研究提出了一种下一代免疫细胞因子概念,设计了一种肿瘤条件下抗PD-L1/IL-15前药——LH05。LH05通过空间位阻创新性地掩蔽IL-15,减轻IL-15的“cytokine sink”效应,并减少野生型抗PD-L1/IL-15的系统性毒性作用。此外,在肿瘤微环境中经过特异性蛋白酶切割后,LH05释放出一种活性IL-15超激动剂,产生强大的抗肿瘤作用。
从机制上讲,LH05的抗肿瘤效果依赖于通过刺激趋化因子CXCL9和CXCL10来增加CD8+T细胞和自然杀伤细胞的浸润,从而将冷肿瘤转化为热肿瘤。此外,肿瘤条件下抗PD-L1/IL-15可以在高级别和转移性肿瘤模型中与溶瘤病毒或免疫检查点阻断疗法协同作用。
该研究为下一代免疫细胞因子的开发提供了令人信服的原理证明,对当前免疫疗法的认知和开发策略具有重要作用。
为了减少免疫细胞因子的全身毒性,一种策略是改造细胞因子以减弱其活性。例如,AcTaferon,包含人干扰素α2(IFNα2;Q124R),其对小鼠细胞的活性比与抗CD20融合的小鼠IFNα低100倍,与野生型IFNα相比,其安全性显著提高。然而,这些突变体对平衡低剂量的抗肿瘤活性不足和高剂量的全身毒性风险提出了挑战。除此之外,肿瘤微环境(TME)中条件性激活细胞因子的前药策略为开发下一代免疫细胞因子带来了巨大希望。傅阳心等人曾将IL-2、IL-12、IL-15和I型干扰素用其天然受体进行基因工程改造,这些促细胞因子在被TME内的肿瘤相关酶裂解后重新激活。虽然受体掩蔽策略可以降低细胞因子的外周活性,但掩蔽受体的引入使其结构复杂化。
IL-15是一种非常有吸引力的免疫刺激细胞因子,因其在治疗各种类型的癌症方面的显著活性而闻名。以IL-15为有效载体的免疫细胞因子,包括靶向PD-L1的KD033和靶向整合素的BJ-001,在临床应用中显示出巨大潜力。
路慧丽团队此前开发了一种抗PD-L1/IL-15免疫细胞因子——LH01,它可以克服PD-L1抗体的耐药,并引起固有免疫和适应性免疫应答。其安全性和有效性均优于PD-L1抗体与IL-15的联用,但正如在上述免疫细胞因子所观察到的那样,其在高剂量下也具有与IL-15相似的全身毒性。
为了应对免疫细胞因子的安全性挑战和加速其临床应用,在这项最新研究中,路慧丽/姜龙团队首先尝试利用IL-15Rα-sushi domain与PD-L1抗体所形成的空间位阻实现了对IL-15活性的掩蔽,设计了减活分子LH03,发现其安全性大幅提高,但抗肿瘤作用同时减弱,说明细胞因子减活策略很难在抗肿瘤药效和安全性之间取得平衡。
研究团队进一步在LH03结构的基础上,将肿瘤组织特异性酶的底物连接子引入到抗PD-L1与IL-15/IL-15Rα-sushi domain之间,构建了抗PD-L1/IL-15免疫细胞因子前药——LH05。在多个耐药及难治性小鼠肿瘤模型上,LH05的安全性和抗肿瘤作用均优于LH01及PD-L1抗体和IL-15联用策略。
此外,LH05还能与其他疗法联用以协同增效,例如通过增强CD8+ T细胞的效应功能从而增强溶瘤病毒的抗肿瘤活性,或与PD-1抗体联用抑制黑色素瘤的肺转移等。
研究团队还进行了非灵长类动物预实验,结果显示,LH05的设计显著降低了cytokine sink效应的影响,在食蟹猴体内表现出较好的安全性,其半衰期达到了单克隆抗体的水平。此外,LH05在人血浆中也具有良好的稳定性,能够选择性地被在人肿瘤组织裂解而非癌旁组织。
这些数据表明LH05具有巨大的临床开发潜力。该研究首次实现了无需引入额外掩蔽基团的IL-15掩蔽技术,LH05是国际上首个报道的肿瘤微环境响应型IL-15免疫细胞因子,为解决临床现有的免疫治疗耐药提供了新的思路,也为细胞因子类药物研发开辟了新的领域。
上海交通大学路慧丽团队长期致力于下一代细胞因子药物的研发,该团队建立的FreeKine细胞因子前药技术平台旨在通过工程化的手段解决细胞因子的成药性问题。目前,该团队针对IL-15这一细胞因子构建了靶向不同抗原的免疫细胞因子前药,并进行了充分的药理学评价,相关专利已获授权。该团队还聚焦其他细胞因子药物开发、造血干细胞移植机制研究和CAR-T细胞开发,结合细胞因子开发联用、因子跨细胞膜表达增强等技术路径,通过上海交通大学强大的体内外技术平台体系和跨学科研究团队,更高效率更低成本地完成细胞因子和免疫细胞相关产品的管线推进,进而造福更多的肿瘤患者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


