Cell:让肿瘤“过敏”,浙江大学顾臻团队发明“肥大细胞”载药平台,增强癌症免疫治疗
来源:生物世界 2025-12-11 10:06
研究团队计划建立患者特异性 IgE 的筛选流程,完善肥大细胞治疗产品的规模生产和质量控制,并探索与现有免疫治疗(例如免疫检查点抑制剂)的协同方案。
有些人一吃海鲜会起荨麻疹,一到花粉季节就喷嚏打不停,这些常见反应都源自人体最快、最强烈的防御机制之一——过敏反应。
而现在,浙江大学的研究团队将这种强大的免疫反应重新定向,不再对抗花粉或食物,而是用来对抗癌症。
2025 年 12 月 10 日,浙江大学药学院、金华研究院和先进药物递释系统全国重点实验室顾臻教授、俞计成教授团队联合中国医科大学附属第一医院刘福囝教授团队(浙江大学博士后徐妍为论文第一作者),在国际大奖学术期刊 Cell 上发表了题为:Sensitized mast cells for targeted drug delivery and augmented cancer immunotherapy 的研究论文。
该研究报道了一个基于工程化肥大细胞的靶向治疗平台,让这些平时在过敏反应中扮演重要角色的细胞,化身为对抗癌症的“快递员”,在动物模型上验证了利用肿瘤相关抗原作为“过敏原”,驱动装载抗肿瘤药物的肥大细胞可在体内主动聚集至肿瘤部位,诱发“过敏反应”并释放药物。

灵感来自过敏反应:肥大细胞的“华丽转身”
肥大细胞(Mast Cell,MC)是我们免疫系统中的特殊成员,它们最著名的功能就是在过敏反应中释放组胺等物质,引起打喷嚏、流鼻涕等过敏症状。但研究团队发现,肥大细胞有一个独特本领:当它们被免疫球蛋白 E(IgE)致敏后,能够特异性地识别并迁移到过敏原所在位置。
研究团队利用这一特点,巧妙地将肿瘤相关抗原作为“过敏原”,通过带有肿瘤特异性识别能力的免疫球蛋白 IgE 抗体对肥大细胞进行“重编程”,构建了工程化的 IgE-MC。当这些工程化肥大细胞被注入体内后,它们会主动迁移到肿瘤部位。一旦识别到相应的肿瘤标志物,就会立即释放炎症因子——在肿瘤内部引发类似过敏的快速反应。这种突然的免疫活动能够“唤醒”免疫系统,使原本隐匿、难被免疫系统识别的“冷肿瘤”,变成更容易被攻击的“热肿瘤”。
多功能递送平台:不仅仅是病毒载体
该研究的亮点在于,IgE-MC 作为一个模块化平台,可以装载多种治疗药物,包括溶瘤病毒、化疗药物、免疫检查点抑制剂、mRNA疫苗等。研究团队重点探索了其递送溶瘤病毒(OV)的能力。
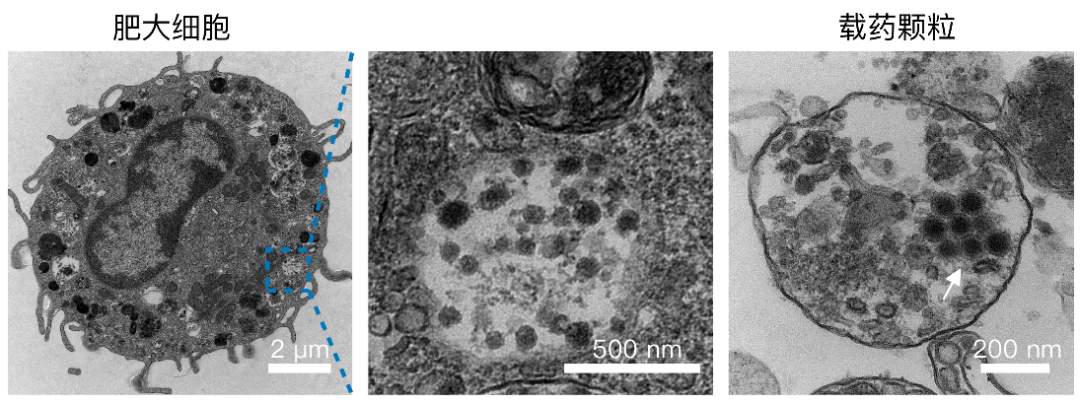
装载溶瘤病毒的肥大细胞透射电镜图片(左);细胞内部含有溶瘤病毒的颗粒的放大图(中);经脱颗粒释放到胞外的含有溶瘤病毒的颗粒透射电镜图(右)
溶瘤病毒本身能够选择性感染并裂解肿瘤细胞,但静脉给药时容易被免疫系统清除。而 IgE-MC 就像给这些病毒穿上了“隐形斗篷”,保护它们顺利到达肿瘤部位。当 IgE-MC 识别肿瘤相关抗原后,会迅速释放其中携带的溶瘤病毒,实现对肿瘤细胞的精准感染。
双重攻击策略:直接杀伤与免疫激活
更令人惊喜的是,IgE-MC 不仅能够递送药物,还能主动改造肿瘤微环境。研究发现,激活的 IgE-MC 会释放一系列趋化因子和炎症介质,特别是 CCL3,能够招募 CD8+ T 细胞到肿瘤部位,增强抗肿瘤免疫反应。
在多种小鼠肿瘤模型中,OV@IgE-MC 治疗都显示出显著效果。在 B16F10-OVA 黑色素瘤小鼠模型中,治疗组小鼠的肿瘤生长明显受到抑制,60% 的小鼠生存期超过 25 天,而对照组小鼠在 15 天内全部死亡。
临床前验证:人源化模型展现应用潜力
为了评估临床转化潜力,研究团队还建立了人源化 HER2 阳性 PDX 模型。结果显示,装载溶瘤病毒的人源 IgE-MC 能够有效抑制肿瘤生长,增加肿瘤内 T 细胞浸润,同时不会诱导促血管生成或转移相关因子的表达。
这表明根据患者肿瘤的标志物匹配相应的 IgE 抗体,即可快速构建个性化的“肿瘤过敏疗法”。
安全可靠:精准靶向减少副作用
安全性评估显示,注入的 IgE-MC 会在 2 周内被清除,不会扰乱组织内肥大细胞稳态或诱导系统性过敏反应。与游离的溶瘤病毒相比,OV@IgE-MC 减轻了肝脏毒性,且在正常组织中未检测到病毒复制。
未来展望:个性化癌症治疗新方向
这项技术的一大优势是易于个性化,与传统需要复杂基因工程的 CAR-T 细胞不同,IgE-MC 只需要在体外用患者特异的 IgE 致敏即可,大大简化了制备流程。
该平台还可以进一步扩展,例如与免疫检查点抑制剂或 STING 激动剂联合使用,有望在免疫豁免型肿瘤中取得更好效果。

基于工程化肥大细胞的靶向药物递送平台构建及其抗肿瘤机制示意图
据悉,研究团队计划建立患者特异性 IgE 的筛选流程,完善肥大细胞治疗产品的规模生产和质量控制,并探索与现有免疫治疗(例如免疫检查点抑制剂)的协同方案。
这项研究为癌症免疫治疗提供了新思路,我们也期待这一“让肿瘤过敏”的创新细胞药物早日从实验室走向临床,为患者带来切实的治疗获益。
论文链接:
https://www.cell.com/cell/abstract/S0092-8674(25)01311-X
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


