首个婴儿型庞贝病酶替代治疗“中国数据”发布,填补本土研究空白
来源:生物谷 2022-08-04 17:52
研究结果显示中国IOPD患儿接受ERT治疗后,生存率提高、心肌肥厚改善、生长发育促进、运动能力发展,疾病进展得到延缓。同时,患儿耐受可,安全性良好。
近日,中国大陆地区首个婴儿型庞贝病(IOPD)酶替代治疗(ERT)研究——APOLLO-IOPD研究数据发布,这是首个在中国大陆进行的溶酶体贮积症酶替代治疗临床研究,填补了该领域本土研究的空白。研究结果显示中国IOPD患儿接受ERT治疗后,生存率提高、心肌肥厚改善、生长发育促进、运动能力发展,疾病进展得到延缓。同时,患儿耐受可,安全性良好。
APOLLO-IOPD研究于2018年启动,是由上海市儿童罕见病临床研究中心/上海交通大学医学院附属上海儿童医学中心牵头,青岛大学附属妇女儿童医院、深圳市儿童医院、上海交通大学医学院附属新华医院共同开展的一项前瞻性、多中心临床研究,旨在评估中国IOPD患儿ERT治疗的有效性及安全性。研究对象为10例确诊的IOPD患儿,患儿每2周接受一次剂量为20 mg/kg的注射用阿糖苷酶α,持续52周。该研究成果于2022年6月27日在《Frontiers in Pharmacology》杂志发表(IF:5.988;期刊分区:中科院2区、JCR Q1)。

上海交通大学医学院附属上海儿童医学中心心内科主任傅立军教授表示:“这是中国大陆第一项针对IOPD患儿ERT治疗的前瞻性、多中心临床研究,填补了中国大陆关于ERT治疗IOPD的有效性及安全性的正式数据的空白。此项研究数据的发表,有助于提升临床医生对于中国IOPD患儿ERT治疗的认知,积累本土ERT治疗的经验,对于临床IOPD治疗中可能遇到的问题提供了实际的参考依据。”
赛诺菲特药全球事业部中国区医学部负责人李健表示:“任何罕见病的临床证据都无比珍贵,相信中国IOPD患儿的ERT研究证据是我国溶酶体贮积症ERT治疗临床证据生成的重要里程碑。赛诺菲将持续与中国临床专家通力合作,产生更多高质量的‘中国数据’,并转化为‘中国方案’,惠及广大中国罕见病患者。”
庞贝病(糖原累积病Ⅱ型),是一种罕见的、致命的常染色体隐性遗传病,是由于编码酸性α-葡糖苷酶(GAA)的基因变异,导致溶酶体内GAA酶活性缺乏或显著降低,糖原不能被降解而贮积在骨骼肌、心肌和平滑肌等细胞的溶酶体内,导致溶酶体肿胀、细胞破坏及脏器功能损伤,并引起一系列临床表现。根据发病年龄、受累器官和疾病进展速度,庞贝病分为婴儿型庞贝病(IOPD)和晚发型庞贝病(LOPD)。IOPD患儿病情进展迅速,若无有效治疗,常于1岁内死于心力衰竭及呼吸衰竭。
酶替代治疗(ERT)是目前已经证明的针对庞贝病的有效治疗方法。2006年美国食品药品监督管理局(FDA)批准使用重组人类酸性α-葡糖苷酶(rhGAA)(注射用阿糖苷酶α)治疗IOPD患儿。国外临床研究显示,6月龄前开始ERT可延长IOPD患儿寿命,3年内病死风险下降95% 。2015年10月,注射用阿糖苷酶α在中国基于全球临床试验获得的有效性和安全性数据批准上市,但缺乏中国大陆患儿酶替代治疗(ERT)的正式数据公布。
关于APOLLO-IOPD研究(NCT03687333)
【研究设计】
该研究是一项多中心、单臂、前瞻性、开放标签的临床试验,研究对象为10例确诊IOPD患儿,所有患儿(100%)均纳入意向治疗(ITT)人群和安全人群。受试者每2周接受一次剂量为20 mg/kg的注射用阿糖苷酶α,持续52周。
1)主要研究终点为治疗52周时生存率和左心室质量指数(LVMI)较基线变化
2)次要研究终点为治疗52周时未使用有创呼吸机和未使用任何呼吸机的生存率,生长发育、GESELL发育量表得分较基线变化以及52周出现心衰体征和(或)症状的受试者比例。
3)安全性指标的观察和记录包括研究期间出现的任何不良事件(AE)、实验室检查、生命体征和心电图的异常。
【研究结果】
1,注射用阿糖苷酶α治疗52周显著改善IOPD患儿生存率
研究结束时,10例患儿中9例存活,1例死亡,生存率为90.0%(95%CI:55.5%~99.7%)。1例使用有创呼吸机,9例未使用有创呼吸机,未使用有创呼吸机的生存率为100%(n=9,95%CI:66.4%~100%)。2例使用呼吸机,8例未使用呼吸机,未使用任何呼吸机的生存率为100%(n=8,95%CI:63.1%~100%)。
提示本研究达到主要研究终点,注射用阿糖苷酶α能够显著改善中国IOPD患儿的生存率,延缓疾病进展。
2,注射用阿糖苷酶α治疗52周显著改善IOPD患儿心肌肥厚
研究期间ITT人群平均左心室质量指数(LVMI)和左心室质量(LVM)Z评分显著下降,基线时分别为298.02±178.43 g/m2和16.63±5.17,第52周时分别为70.59±39.93 g/m2和4.30±2.78。所有患儿基线时LVM Z评分>10,第52周时8例患儿(80%)LVM Z评分<5,1例患儿LVM Z评分<2。
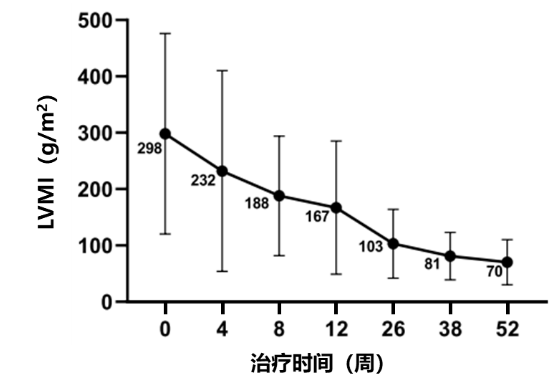
中国IOPD患儿平均LVMI自基线至第52周的变化情况
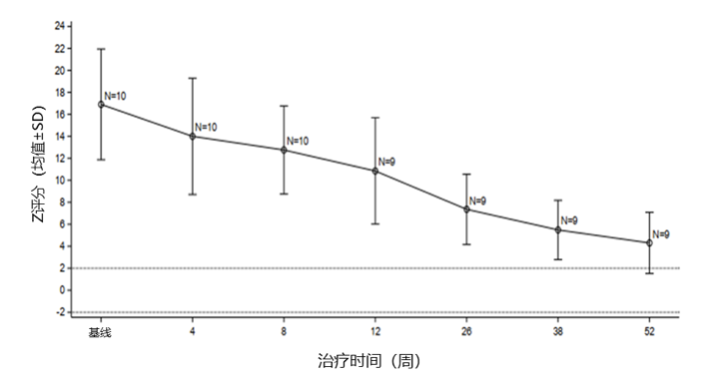
中国IOPD患儿LVM Z评分自基线至第52周的变化情况
此外,研究过程中,2名受试者(20%)在第4周和1名受试者(10%)在第8周出现心力衰竭的体征和/或症状。第52周时,没有受试者表现出任何心力衰竭的迹象和/或症状。
3,注射用阿糖苷酶α治疗52周明显改善IOPD患儿生长发育
治疗期间患儿的身长和体重呈增长趋势。第52周时,身长较基线增加12.66±4.68 cm,体重增加2.69±0.75 kg。基线时,有9例(90%)和7例(70%)患儿的身长和体重高于或等于其适龄身长和体重的第3百分位;第52周时,7例患儿(70%)的身长大于或等于适龄身长的第3百分位,5例患儿(50%)的体重大于或等于适龄体重的第3百分位。
所有患儿在治疗期间均获得了新的运动发育里程碑。基线时,6例患儿(60%)表现出至少一项运动发育里程碑:5例患儿可以抬起头,1例能辅助坐起,1例能翻滚,1例能用腿承重;第52周时,9例存活患儿均达到一项或多项运动发育里程碑:所有患儿均能抬头和辅助坐下,8例能翻滚,7例能自主坐起,3例能用腿承重,3例能辅助行走,2例能拉着站起,1例能自主行走,1例能上台阶。GESELL发育量表显示IOPD患儿运动、适应(认知)、语言、个人-社会行为等综合发育进步显著,52周时较基线变化分别为5.87±3.68、8.50±3.26、6.82±3.05和8.73±3.11。
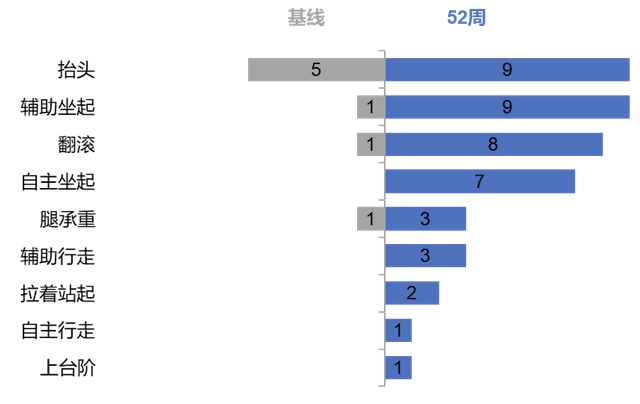
52周时患儿获得运动发育里程碑例数较基线变化
4,注射用阿糖苷酶α治疗IOPD具有良好的安全性
研究期间,9例患儿(90%)共报告27次严重不良事件(SAE)。所有SAE均与研究药物无关,且大部分在研究期间缓解或恢复。没有患儿因SAE而中止研究。输注相关反应(IAR)如皮疹、发热和荨麻疹并不常见。
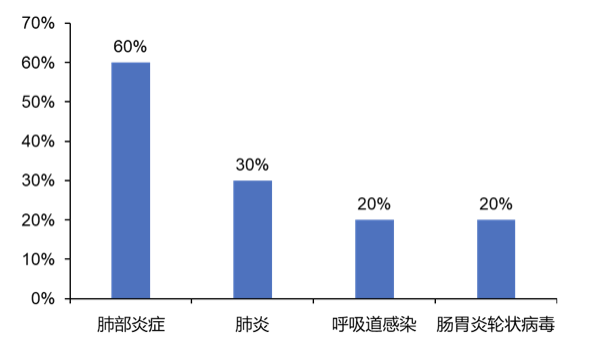
研究过程中最常报告(≥20%)的严重不良事件
5,交叉免疫反应物质(CRIM)状态影响ERT效果
CRIM状态是指患儿体内有无内源性GAA的存在,如果体内完全丧失内源性GAA,称为CRIM阴性,当给予ERT后,患儿免疫系统会将其作为外来抗原而诱导机体产生中和抗体,从而严重削弱ERT疗效。对于CRIM阴性IOPD患儿,在接受ERT前可给予免疫耐受诱导治疗(ITI),即通过给予患儿免疫抑制剂以避免或减少抗体的产生,最常用的方案为抗CD20单抗(利妥昔单抗)、甲氨蝶呤和免疫球蛋白联合应用,其疗效取决于接受ITI的早晚。在该研究中,1例CRIM阴性患儿在ERT前接受了ITI,但由于应用时间较晚导致疗效不佳,最终在家属放弃治疗后发生AE(窒息)导致死亡,与研究药物无关。该结果表明,CRIM是影响ERT治疗效果的重要因素,对于CRIM阴性的IOPD患儿需要尽早开展ITI+ERT治疗。
参考文献:
1,Zhu D, et al. Front Pharmacol 2022,13:903488.
2,中华医学会儿科学分会内分泌遗传代谢学组. 儿童糖原累积病Ⅱ型诊断及治疗中国专家共识. 中华儿科杂志 2021,59(6):439-445.
3,Kishnani PS, et al. Neurology. 2007,68(2):99-109.
4,Kishnani PS, et al. Pediatr Res 2009,66(3):329-335.
5,Bali DS, et al. Am J Med Genet C Semin Med Genet 2012,160C(1):40-49.
6,Banugaria SG, et al. PLoS One. 2013,8(6):e67052.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


