重要研究成果解读科学家们在炎性肠病研究领域取得的新成果!
来源:本站原创 2021-11-27 15:32
炎性肠病是一种病因不明确的慢性非特异性肠道炎症性疾病,其包括克罗恩病、溃疡性结肠炎和未定型的炎性肠病。目前全球有超过1000万的人罹患炎性肠病,而我国的发病率为1.77/10万~3.14/10万。目前炎性肠病的发病原因尚不清楚,科学家们认为是具有遗传易感性的个体在环境因素的刺激和肠道微生物共同参与下出现的异常免疫反应,最终表现为以肠道炎症反应为主的全身性炎性
炎性肠病是一种病因不明确的慢性非特异性肠道炎症性疾病,其包括克罗恩病、溃疡性结肠炎和未定型的炎性肠病。目前全球有超过1000万的人罹患炎性肠病,而我国的发病率为1.77/10万~3.14/10万。目前炎性肠病的发病原因尚不清楚,科学家们认为是具有遗传易感性的个体在环境因素的刺激和肠道微生物共同参与下出现的异常免疫反应,最终表现为以肠道炎症反应为主的全身性炎性疾病。
本文中,研究人员整理了多篇重要研究成果,共同解读科学家们在炎性肠病研究领域取得的新成果,分享给大家!
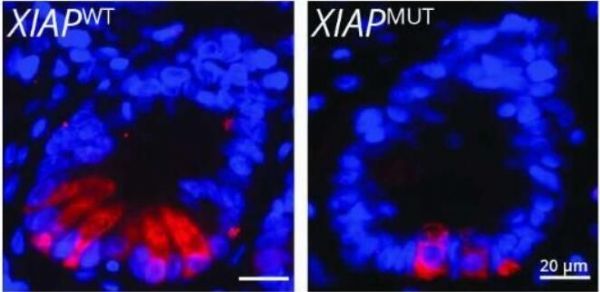
IBD患者小肠隐窝中的XIAP基因未发生改变(左)以及发生突变(右)。
图片来源:Anne Strigli
【1】Sci Immunol:科学家识别出对炎性肠病发生和预防非常关键的分子通路
doi:10.1126/sciimmunol.abf7473
炎性肠病(IBD)包括克罗恩病和溃疡性结肠炎,其是一种起源不明的慢性炎性疾病,由于遗传因素常常会促进炎性肠病的风险,仅一小部分人群会携带诱发该疾病的遗传风险,这就表明,其它环境因素或在炎性肠病发生过程中也扮演着重要角色。近日,一篇发表在国际杂志Science Immunology上题为“Deficiency in X-linked inhibitor of apoptosis protein promotes susceptibility to microbial triggers of intestinal inflammation”的研究报告中,来自德累斯顿大学等机构的科学家们通过研究识别出了一种引发肠道炎症的新型通路,文章中,研究者揭示了人类遗传缺陷是如何促进对细菌所引发的肠道炎症变得非常易感的,相关研究结果或有望帮助科学家们开发治疗炎性肠病的新型疗法。
有超过200个不同的基因组区域能调节炎性肠病的风险,然而,这些风险基因促进炎性肠病发生的特殊通路以及其与环境之间的相互作用在很大程度上科学家们并不清楚;遗传因素和环境因素之间的相互作用或许使得炎性肠病成为了一种非常复杂的疾病,此外,对该疾病的研究也是科学家们所面临的巨大挑战之一。
这篇研究报告汇总,研究人员研究了基因X连锁凋亡抑制蛋白(XIAP)中的突变,大约30%携带这种突变的人群都会患上炎性肠病,这就表明该遗传因素对患病风险有着很大的影响,同时也表明,遗传背景或许只是其中的一部分;为此研究人员对XIAP突变进行了相关研究,从而来分析遗传缺陷和环境因素之间的串扰如何促进炎性肠病的发生。研究人员观察到,人类和小鼠机体中XIAP基因的缺失或与潘氏细胞(Paneth cells)的缺陷有关,潘氏细胞是一种位于小肠内壁的特殊细胞,其对于控制机体微生物组也非常重要;这些细胞能产生小分子来扮演抗生素的角色,当分泌到肠道中时,这些分子就会杀灭细菌;这样一来,机体微生物组的组成就会得到控制,细菌也会被阻断进入到肠道组织中;如果没有功能性的XIAP基因,潘氏细胞就不会以同样的程度产生并释放抗菌分子,这反过来就会导致微生物组功能失衡。
【2】BMJ:大量摄入超级加工食物或与机体炎性肠病发病风险增加直接相关
doi:10.1136/bmj.n1554
炎性肠病(IBD)是一种机体胃肠道的慢性炎症疾病,其包括克罗恩病和溃疡性结肠炎,炎性肠病的病理生理学特征被认为与肠道粘膜的免疫系统激活有关,从而会对遗传易感性人群机体胃肠道的菌群失调产生反应。饮食会改变机体的微生物组并修饰肠道免疫反应,从而在炎性肠病的发病过程中扮演着关键作用。近日,一篇发表在国际杂志BMJ上题为“Association of ultra-processed food intake with risk of inflammatory bowel disease: prospective cohort study”的研究报告中,来自麦克马斯特大学等机构的科学家们通过研究发现,大量摄入超级加工食物或与高风险的炎性肠病发生直接相关。
超级加工食物包括已经包装好的烘焙食物和零食、发泡饮料、含糖谷物、含有添加剂的即食食品、重组的肉类和鱼类产品,这些食物中通常含有高水平的添加糖、脂肪和盐分,但缺乏微生物和纤维素。炎性肠病在工业化国家中的人群中非常常见,科学家们常常认为饮食因素在其中扮演着重要作用,但将超级加工食物与炎性肠病风险相关联的数据非常有限。为此,本文中,研究人员通过对生活在21个低、中和高收入国家年龄在35-70岁之间的116,087名成年人进行研究,详细分析了其饮食信息,并将其纳入到前瞻性城市农村流行病学调查计划(PURE Study)中,该研究分析了来自全球不同国家中的社会影响因素对人群慢性疾病的影响。
参与者在2003-2016年间加入到了这项研究中,同时其每三年接受一次评估,在平均9.7年的随访过程中,研究人员记录了被诊断为炎性肠病的参与者。研究期间,共有467名参与者患上了炎性肠病,包括90名克罗恩病患者和377名溃疡性结肠炎患者。在考虑了其它额外的影响因素后,研究者发现,大量摄入超级加工食物或与参与者炎性肠病发病风险增加直接相关。比如,相比每天摄入少于一份超级加工食物而言,每天摄入5份甚至以上超级加工食物的参与者患炎性肠病的风险会增加82%,每天摄入1-4份超级加工食物的参与者的风险则会增加67%。
【3】Nat Med:工程化的酵母益生菌或有望帮助治疗人类炎性肠病
doi:10.1038/s41591-021-01390-x
炎性肠病(IBD,Inflammatory bowel disease)是机体胃肠道的一种复杂慢性炎性障碍,由机体共生微生物和宿主细胞所产生的胞外三磷酸腺苷(eATP)能够激活嘌呤信号,并促进肠道炎症和病理学表现。生活在人类肠道中的微生物世界会对人类健康产生深远的影响,包括炎性肠病在内的多种疾病都与这些微生物的平衡有关,这表明,恢复微生物菌群正确的平衡或能帮助治疗疾病,目前市场上的许多益生菌(包括活的酵母菌和细菌)已经在健康肠道的背景下通过进化得到了一定的优化;然而,为了治疗诸如炎性肠病等复杂的人类疾病,研究人员就需要利用益生菌来发挥多种功能,包括关闭炎症的能力、逆转损伤且恢复肠道微生物组的功能。近日,一篇发表在国际杂志Nature Medicine上题为“Self-tunable engineered yeast probiotics for the treatment of inflammatory bowel disease”的研究报告中,来自多伦多大学等机构的科学家们通过研究开发了一种“设计者益生菌”,这种经过改造的工程化酵母菌或能帮助诱导多种治疗炎性肠病的多种效应。
研究者Francisco Quintana博士表示,我们能赋予用来制造啤酒的酵母感知炎症并分泌抗炎性分子的能力,我们所开发的新平台为“Y-bots”(即“酵母机器人”),其或能帮助开发新型疗法来治疗肠道组织甚至更多机体组织所出现的疾病。此前研究结果揭示了肠道和影响大脑的疾病之间的关联,同时也强调了工程化的益生菌除了治疗炎性肠病外的其它治疗用途。
这篇研究报告中,研究人员利用酿酒酵母(Saccharomyces cerevisiae)开发了特殊的益生菌,在基因魔剪CRISPR/Cas9的帮助下,研究人员引入了能感知炎症并对其产生反应的遗传元件,其能通过分泌特殊酶类来降解参与机体炎症发生的关键分子。这种工程化的酵母菌能分泌多种水平的酶类,这主要取决于肠道某个位置所存在的炎性信号的水平,这就意味着这种益生菌或许会对炎症产生一种高度局部化的反应;在小鼠机体中,这种工程化的酵母菌能成功抑制肠道炎症,并降低纤维化发生且能恢复肠道微生物组的平衡。
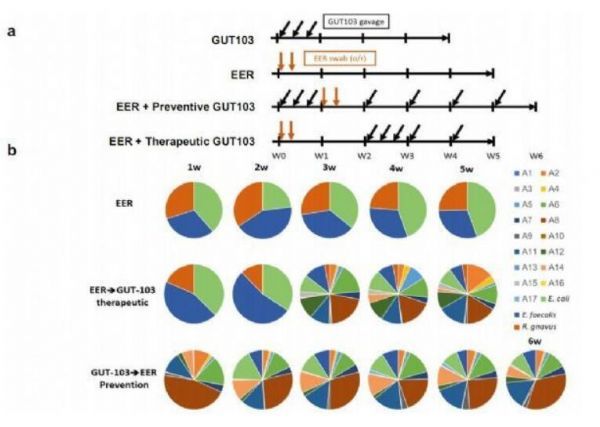
GUT-103对肠道微生物组等参数的影响效应。
图片来源:van der Lelie, et al. Nat Commun 12, 3105 (2021).
doi:10.1038/s41467-021-23460-x
【4】Nat Commun:有益菌群GUT-108或有望帮助治疗多种人类炎性肠病
doi:10.1038/s41467-021-23460-x
环境因素、粘膜通透性和免疫调节缺陷能促进机体对一类介导多种炎性疾病的常驻肠道菌群产生过度活性的免疫反应;GUT-103和GUT-108是两种活体生物治疗性产品,其主要用于补充炎性肠病患者机体失调的微生物组中缺失或代表性不足的功能,并能帮助解决上游靶点,而并非靶向作用单一细胞因子来阻断下游炎性反应。
近日,一篇发表在国际杂志Nature Communications上题为“Rationally designed bacterial consortia to treat chronic immune-mediated colitis and restore intestinal homeostasis”的研究报告中,来自北卡罗来纳大学等机构的科学家们通过研究发现,一种能补充炎性肠病患者机体失衡微生物组缺失或代表性不足功能的细菌群体,在人源化小鼠模型中或能预防并治疗慢性免疫介导的结肠炎,相关研究结果对于开发新型疗法来治疗克罗恩病和溃疡性结肠炎至关重要。
研究者表示,这种疗法的设想就是恢复肠道中保护性细菌的正常功能,靶向作用炎性肠病的诱因,而不是利用传统的免疫抑制剂来治疗相应的疾病症状,因为这些免疫抑制剂能诱发诸如感染或肿瘤等副作用。GUT-103由17种细菌组成,其能相互协作来保护彼此并哺育彼此。GUT-108则是GUT-103的优化版本,其利用了与17种细菌相关的11种人类细菌,与其它无法在肠道中生存并快速通过系统的益生菌相比,这些组合允许细菌在结肠内停留更长时间。
doi:10.1136/gutjnl-2020-322146
近日,一篇刊登在国际杂志Gut上的研究报告中,来自鲁汶大学等机构的科学家们通过对人类和小鼠进行研究开发了一种新方法,其能指挥免疫系统细胞来帮助修复肠道中的组织损伤;这或许有望帮助开启炎性肠病的有效治疗方法,包括溃疡性结肠炎和克罗恩病等。当功能正常时,免疫系统会保护机体抵御有害因子的侵袭,比如细菌和病毒等,但在诸如炎性肠病等状况下,免疫系统则能够攻击肠道中的组织,从而形成溃疡、疼痛和机体不适感。目前全球大约由390万女性和300万男性患有炎性肠病,而且患者数量一直在不断上升。
由于炎性肠病的起源研究人员并不清楚,因此治疗上通常重点关注如何减少机体免疫反应来限制炎症及所产生的疾病症状,但这也会妨碍到参与修复损伤肠道组织的部分免疫系统的功能,比如,巨噬细胞就在炎症和组织修复过程中扮演关键角色,其会吞噬外来入侵者,清理损伤细胞所产生的碎片,并释放特殊物质指导机体炎症或修复过程。
研究者Gianluca Matteoli教授说道,我们的想法就是在炎性肠病中巨噬细胞迁移到损伤组织中对于刺激其损伤部位的修复是非常必要的;为此这项研究中,研究人员就进行了一系列研究来证实这种想法;当他们观察多名炎性肠病患者肠道中的巨噬细胞时,发现了一类能对前列腺素E2(PGE2)产生反应的细胞亚群,前列腺素是免疫系统中与组织再生相关的信使分子。
【6】Lancet子刊:抗生素的使用或与个体炎性肠病风险增加直接相关
doi:10.1016/S2468-1253(20)30267-3
近日,一项刊登在国际杂志The Lancet Gastroenterology & Hepatology上的研究报告中,来自瑞典卡罗琳学院等机构的科学家们通过研究发现,抗生素的使用(尤其是微生物覆盖范围更广的抗生素,广谱抗生素)或与人群新发炎性肠病(IBD)及其亚型溃疡性结肠炎和克罗恩病的发病风险增加直接相关。当研究者将患者与其兄弟姐妹们进行比较时,抗生素疗法与其患IBD之间的关系或许仍然存在。
如今,IBD在全球变得越来越普遍,尤其是在欧洲、美国等国,因为这些地区正在经历着经济的快速发展、卫生条件的改变及抗生素更频繁的使用;随着人们越来越重视肠道菌群在维持人类机体健康中扮演的关键角色,他们开始会担心抗生素的使用或许会扰乱且永久性地改变机体的微生物群落,这或许就会潜在影响个体患胃肠系统疾病的风险。
在这项分析抗生素疗法与IBD风险之间关联的大型研究中,研究人员清楚地阐明,抗生素的频繁使用或与个体患IBD、溃疡性结肠炎和克罗恩病直接相关;研究者Long Nguyen说道,本文研究结果或许肯定了很多人的怀疑,即对肠道菌群产生负面影响的抗生素是IBD患病的一个风险因素。然而,尽管有这种令人信服的理论基础和看似更为直观的假设,目前研究人员还并未进行基于人口规模的调查分析来支持这一假设。
这项研究中,研究人员识别出了大约2.4万名IBD患者(包括1.6万名溃疡性结肠炎患者和8000名克罗恩病患者),并将这些患者与其2.8万名兄弟姐妹、以及11.7万名一般对照人群进行比较分析,结果表明,当调整了多个风险因素后,此前使用过抗生素或会让个体患IBD的风险增加近两倍,而且溃疡性结肠炎和克罗恩病的患病风险都有所增加,其中使用广谱抗生素对应的患病风险或许更高。
【7】Genome Med:抵御肠道感染或能帮助预防克罗恩病和溃疡性结肠炎
doi:10.1186/s13073-021-00996-7
如今遗传学研究已经能够成功识别与多种表型相关的基因组区域,尽管这些研究在确定因果基因及其突变和功能影响上的成功较为有限;近日,一篇发表在国际杂志Genome Medicine上题为“Functional screen of inflammatory bowel disease genes reveals key epithelial functions”的研究报告中,来自蒙特利尔大学等机构的科学家们通过研究发现,特定肠道细胞中的基因或许能保护机体抵御炎性肠病的发生,相关研究结果表明,促进克罗恩病和溃疡性结肠炎发生的多个基因或许能帮助机体抵御病毒和细菌感染。
克罗恩病和溃疡性结肠炎俗称为炎性肠病,其主要特点为机体慢性的消化系统炎症,文章中,研究人员筛选出了人类消化系统细胞—肠道上皮细胞中与炎性肠病风险相关的145个基因,同时发现其中很多基因能有效帮助肠道上皮细胞来检测细菌或病毒,并能建立适当的防御性反应来控制诸如此类感染;因此,研究人员就能识别出让人类更易于患上慢性肠道炎症的基因,而这或许是被遗传突变所干扰时的炎性肠病的特征。
研究者John D. Rioux博士说道,当前用来治疗克罗恩病和溃疡性结肠炎的大部分疗法都能靶向作用机体免疫系统细胞的功能;本文研究揭示了开发新型疗法的重要性,这些疗法旨在加强消化系统保护炎性肠病患者并让其获益的作用。目前加拿大有超过27万人患有炎性肠病,每年几乎有1万人被确诊为该病,这或许就会导致每年在治疗这种疾病上花费26亿美元;炎性肠病的主要特征为机体自身的免疫系统会攻击部分消化系统,然而目前研究人员并不清楚炎性肠病发生背后的具体原因,同时也并没有有效的靶向性疗法治疗这类疾病。
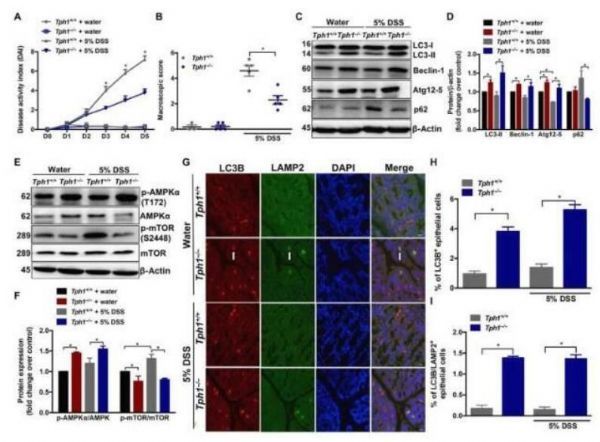
减少5-HT对DSS诱导的结肠炎小鼠整个结肠组织发生自噬的影响。
图片来源:SABAH HAQ,et al. Science Advances (2021). DOI: 10.1126/sciadv.abi6442
【8】Sci Adv:新发现!血清素或是引发克罗恩病的关键因素!
doi:10.1126/sciadv.abi6442
细胞自噬(autophagy)是一种重要的细胞内再循环过程,其与包括克罗恩病在内的多种疾病的发病机制有关,目前研究人员并不清楚在肠道炎症期间导致自噬过程受损的因素和机制;近日,一篇发表在国际杂志Science Advances上题为“Disruption of autophagy by increased 5-HT alters gut microbiota and enhances susceptibility to experimental colitis and Crohn’s disease”的研究报告中,来自麦克马斯特大学等机构的科学家们通过研究发现血清素或能作为一种诱发克罗恩病的诱发因素,相关研究结果或有望帮助研究人员开发治疗该病的新型疗法。
文章中,研究者发现,机体中血清素水平的增加或能预防肠道细胞发生自噬过程,自噬过程是清除受损或功能异常细胞组分的一种程序。研究人员通过对来自两组共18名克罗恩病患者机体的血液和活组织样本进行分析,并将其与来自两组数量相匹配的健康对照个体进行比较研究,同时研究人员还使用了炎性肠病的小鼠模型。
研究者Waliul Khan指出,由此所产生的自噬功能异常或许会引发诸如克罗恩病等炎性肠病及其它疾病,比如糖尿病和帕金森疾病等。血清素能被名为肠嗜铬细胞(enterochromaffin cells)的产激素细胞所操控,肠嗜铬细胞位于肠道菌群附近,这对于诱发炎性肠病的发生非常重要。如今研究人员揭示了血清素增加炎性肠病患者机体炎症的分子机制,同时其还能作为细胞自噬的制动器,改变肠道菌群的组成,随后就会导致更多炎性细胞因子和更多严重疾病的产生。
【9】Sci Rep:新发现!克罗恩病实际上或是一种脂肪性肠道疾病!
doi:10.1038/s41598-021-98798-9
克罗恩病(CD)是一种病因不明的衰弱性炎性肠病,近年来其在全球的发病率越来越高,大规模的研究已经确定了女性肥胖或低BMI分别与所有年龄段或8-40岁人群患克罗恩病的风险有关;对于男性而言,进入成年期后其机体较低的BMI与40年后克罗恩病发病风险或溃疡性结肠炎的风险增加有关;机体成分分析结果表明,机体无脂肪组织和高内脏脂肪的组合或能预测不良的克罗恩病患者预后。
近日,一篇发表在国际杂志Scientific Reports上题为“Adults with Crohn’s disease exhibit elevated gynoid fat and reduced android fat irrespective of disease relapse or remission”的研究报告中,来自利默里克大学等机构的科学家们通过研究揭示了机体脂肪组织和克罗恩病发病之间的直接关联;研究人员首次发现,克罗恩病实际上可能是一种脂肪性肠道疾病。
研究者Colum Dunne表示,克罗恩病患者将脂肪整合入机体的方式或与未患克罗恩病的人群不同,其似乎更喜欢将脂肪堆积到机体的下部而并非腹部。这篇研究报告中,研究者发现,在肠道组织所处的腹部区域,克罗恩病相关的溃疡或病变以及炎症都与较高的脂肪沉积有关;更简单地说,在机体整体脂肪相对较少的部分,疾病的显示或与肠道周围的脂肪组织有关。
这篇研究报告中,研究人员利用了一种新方法来重点研究患者机体的肠道疾病;他们汇集了对肠道解剖学、生物化学信号等在机体成分分析方面的专业知识,这种分析更多的是用于研究运动员或观察机体随着年龄增长所发生的改变;文章中研究人员发现了相关证据表明,克罗恩病以及肠道中发生炎症的位置或与这些位点的脂肪组织直接相关。此外,克罗恩病患者似乎能将脂肪以一种未患该病的人群机体中的不同方式整合到其机体中。这项最新研究基于此前研究人员进行的肠系膜微生物学和血源性生物标志物的检测等相关领域的研究,研究人员的开创性研究将称之为肠系膜的人类消化系统的一部分重新分类为一个新的器官。
【10】Nature:首次构建出迄今为止最全面的人类肠道细胞图谱,并揭示克罗恩病和其他炎症性肠病的起源
doi:10.1038/s41586-021-03852-1 doi:10.1038/s41586-021-03620-1
许多疾病起源于人类早期发育。一项新的研究揭示了来自人类细胞图谱(HCA)联盟的研究人员如何推进这方面的理解。HCA联盟正在绘制人体的每一种细胞类型,以改变我们对生物学、感染和疾病的认识。相关研究结果发表在2021年9月9日的两篇Nature论文中,论文标题为“Cells of the human intestinal tract mapped across space and time”和“A roadmap for the Human Developmental Cell Atlas”。
这项新的大规模研究绘制了人类肠道细胞从早期发育到成年的图谱,构建出迄今为止最全面的肠道细胞图谱。这揭示了克罗恩病可能是由发育途径的激活引起的,并发现了治疗克罗恩病和其他炎症性肠病的潜在药物靶标。这种详细的图谱将有助于解释肠道的形成和功能,并将改变对肠道疾病的研究。
第二篇论文揭示了这个构建整个人类发育细胞图谱(human developmental cell atlas, HDCA)的巨大雄心计划,该图谱包含了对人类健康发育非常重要的所有细胞。肠道只是其中的一个例子,而且来自人类细胞图谱发育生物学网络(Human Cell Atlas Developmental Biological Network)的研究人员和他们在世界各地的合作者展示了他们将如何在空间和时间上全面绘制发育中的组织。HDCA是了解早期发育中发生的事件以及这如何影响健康或导致疾病的关键,它可能会导致医疗保健领域的变革。
肠道是一种由多种细胞类型组成的复杂组织,在早期发育过程中变化巨大。为了了解肠道的发育和功能,来自英国韦尔科姆基金会桑格研究所、纽卡斯尔大学、剑桥大学的研究人员及其在HCA联盟中的合作者研究了来自发育中的组织以及儿童和成人供者的超过三分之一的肠道细胞。利用前沿的单细胞基因组学和空间分析技术,这些作者揭示了每个肠道细胞中哪些基因是活跃的,并创建了在不同时间和肠道12个区域的高度广泛的肠道细胞图谱。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。