巨噬细胞产生的 TGFBI 有助于卵巢癌的免疫抑制微环境
来源:本站原创 2021-10-20 19:57
肿瘤微环境在恶性进展过程中发生变化,主要发生在非恶性细胞、细胞因子网络和细胞外基质(ECM)。
肿瘤微环境在恶性进展过程中发生变化,主要发生在非恶性细胞、细胞因子网络和细胞外基质(ECM)。在本研究中,我们旨在了解浆液性输卵管上皮内癌病变(STIC)向高级别浆液性卵巢癌(HGSOC)转化过程中ECM的变化。对人类输卵管 (FT) 和卵巢的机械特性的分析表明,与正常或患病的卵巢相比,正常的输卵管和输卵管具有较低的组织模量(衡量刚度的指标)。蛋白质组学分析显示,FT、毛和卵巢之间的基质体部分在ECM蛋白转化生长因子β诱导(TGFBI -也称为βigh3)中存在显著差异。
菌毛中的 STIC 病变表达高水平的 TGFBI,其主要由 STIC 上皮细胞附近的 CD163 阳性巨噬细胞产生。体外TGFβ和IL4刺激巨噬细胞可诱导TGFBI的分泌,而IFNɣ/LPS下调巨噬细胞TGFBI的表达。携带临床相关TP53突变的不朽FT分泌上皮细胞刺激巨噬细胞分泌TGFBI和上调整合素αvβ3 (TGFBI受体)。转录组HGSOC数据集显示TGFBI表达与交替激活的巨噬细胞信号之间存在显著相关性。
在体外,HGSOC转移的成纤维细胞表达TGFBI并刺激巨噬细胞产生TGFBI。用抗tgfbi抗体治疗小鼠HGSOC肿瘤可减少腹膜肿瘤大小,增加肿瘤单核细胞,并激活表达β3的非传统T细胞。综上所述,TGFBI可能有利于在晚期HGSOC中持续存在的免疫抑制微环境。
图片来源:https://pubmed.ncbi.nlm.nih.gov/34561272/
越来越多令人信服的数据显示,输卵管分泌上皮细胞(FTSE)是许多高级别浆液性卵巢癌(hgsoc)的祖细胞。最早的前体是p53信号,它进一步转化为浆液性输卵管上皮内癌(stacs),在有或没有家族性卵巢癌的女性的输卵管毛中都能发现。这些STICs与HGSOC细胞有共同的特点。ECM成分的异常调节是肿瘤转化的关键病理过程之一,ECM重塑导致细胞行为和生长的异常。恶性细胞引起的间质粘连促进深层结构改变和组织硬化。肿瘤基质主要由成纤维细胞沉积,但免疫细胞,特别是巨噬细胞,也与生理和异常的ECM表达有关。
该研究小组发表了HGSOC大网膜转移的基质组的蛋白质组学分析,揭示了基质特征,可以预测患者的生存。此外,作者发现HGSOC的大网膜转移比健康的大网膜硬100倍。然而,输卵管前体病变的ECM尚未得到广泛的研究。转移性 HGSOC 细胞附着并浸润内源性 ECM 水平相对较低的网膜组织,而卵巢中的 STIC 病变和早期 HGSOC 正在基质丰富的微环境中发展。
目前尚不清楚转化的 FTSE 细胞为何以及如何从输卵管的菌毛末端扩散并粘附到卵巢表面。由于ECM介导粘连、迁移和侵袭,作者建议了解输卵管和卵巢的生物力学和基质体特征将有助于人们了解早期HGSOC。
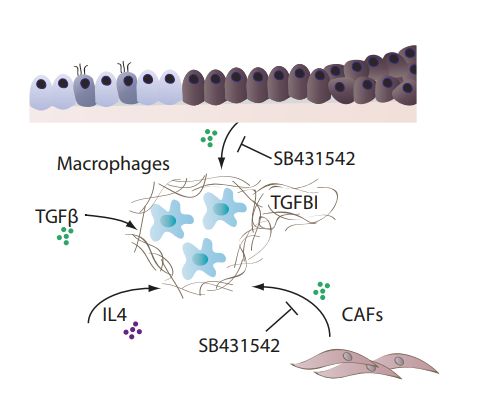
在转化的早期阶段,菌毛中的 FTSE 细胞在巨噬细胞中诱导 TGFBI,部分通过 TGFb 的分泌。
图片来源:https://pubmed.ncbi.nlm.nih.gov/34561272/
在这里,作者发现ECM蛋白转化生长因子β
(TGFBI也被称为big-h3)在卵巢STIC病变和HGSOC间质中显著上调。作者还发现肿瘤相关巨噬细胞(TAMs)是STIC病变中分泌TGFBI的主要细胞类型。在进一步的体外实验中,利用作者最近开发的原位HGSOC模型进行的硅和小鼠模型实验使作者得出结论,TGFBI是HGSOC不同部位和阶段的肿瘤微环境的重要组成部分,它可能有助于免疫抑制和疾病进展。(生物谷Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



