近年来科学家在儿童白血病研究领域取得的重要研究成果!
来源:本站原创 2021-09-26 16:14
一直以来,科学家们在儿童白血病的治疗上都面临着诸多挑战,近年来科学家们通过不断深入的研究在儿童白血病研究领域取得了多项重要研究成果,本文中,小编就对相关研究进行整理,分享给大家!图片来源:Wikimedia Commons【1】Blood Adv:揭开儿童急性髓性白血病的潜在致命性弱点 有望帮助新型靶向性疗法doi:10.1182/bloodadvances
一直以来,科学家们在儿童白血病的治疗上都面临着诸多挑战,近年来科学家们通过不断深入的研究在儿童白血病研究领域取得了多项重要研究成果,本文中,小编就对相关研究进行整理,分享给大家!
图片来源:Wikimedia Commons
【1】Blood Adv:揭开儿童急性髓性白血病的潜在致命性弱点 有望帮助新型靶向性疗法
doi:10.1182/bloodadvances.2020003737
体细胞突变在小儿急性髓性白血病(pAML)中非常罕见,这表明需要采取替代性的治疗策略来识别出可用于靶向作用的依赖性关系。日前,一篇发表在国际杂志Blood Advances上题为“Defining the Transcriptional Control of Pediatric AML Highlights RARA as a Super-Enhancer Regulated Druggable Dependency”的研究报告中,来自贝勒医学院等机构的科学家们通过研究揭开了儿童急性髓性白血病(AML)的潜在致命性弱点,或有望帮助开发治疗这种疾病的新型疗法。
文章中,研究人员首次在AML患儿机体细胞中识别出了特定的超级增强子(SE,super enhancers),即驱动特定基因产物过度产生的DNA区域;这些超级增强子区域与白血病促进基因直接相关,而且与此前公布的成年AML患者机体的超级增强子基本不同;其中一个值得关注的超级增强子还与RARA基因有关,研究人员所研究的儿童AML样本中有64%的样本中都携带RARA超级增强子。
在实验室培养物和动物模型中,携带RARA超级增强子的AML细胞对药物疗法他米巴罗汀(tamibarotene)非常敏感,从而就延长了白血病患者的生存期并能减少其疾病负担;相反,没有携带RARA超级增强子的AML细胞则对他米巴罗汀疗法并不敏感。相关研究结果支持科学家们开展相应的临床试验来评估他米巴罗汀治疗携带高水平RARA的AML患儿的效果。
【2】PNAS:药物5-氮杂胞苷或有望治疗小儿T细胞急性淋巴细胞白血病
doi:10.1073/pnas.2110758118
小儿T细胞急性淋巴细胞白血病(T-ALL,T-cell acute lymphoblastic leukemia)是一种侵袭性的恶性肿瘤,其是由胸腺中不成熟的T细胞过量繁殖而来,典型特征为DNA甲基化的广泛改变。由于复发性T-ALL患者的存活率仍然很低,为10%-25%,开发预防癌症复发的靶向性疗法的关键在于改善患者的预后,尽管DNA去甲基化酶TET2的突变在成人T细胞恶性肿瘤中很常见,但T-ALL的TET2突变却很罕见。
近日,一篇发表在国际杂志Proceedings of the National Academy of Sciences上题为“TET2 as a tumor suppressor and therapeutic target in T-cell acute lymphoblastic leukemia”的研究报告中,来自瑞典林雪平大学等机构的科学家们通过研究发现,在很大一部分小儿T细胞急性淋巴细胞白血病中肿瘤抑制性基因TET2处于沉默状态;该基因能被当前一种名为5-氮杂胞苷的药物疗法再度激活,相关研究结果表明,5-氮杂胞苷或能作为治疗小儿ALL的一种新型靶向性疗法。
研究者Colm Nestor说道,T-ALL对于受影响患儿和其家庭而言是一种毁灭性的疾病,5名患儿中就有1名无法存活,本文研究中,研究人员的最终目标就是确保所有儿童都能被治愈,同时该研究也为5-氮杂胞苷后期进入临床研究阶段铺平了道路,同时其也有望作为一种新型疗法,研究者认为,对T-ALL的治疗选择越多,我们就越有机会战胜这种侵略性的癌症。
癌细胞的特征之一就是会失去其细胞身份,就好像忘记了自己应该是肝细胞、脑细胞或免疫系统细胞一样,这种身份丧失的其中一种原因就是,在某些特定细胞中原本应该被激活的基因被关闭表达了,同时其它基因则会被错误地激活;基因的激活和失活会被一种名为表观遗传学修饰的过程所控制,即小型的化学基团会吸附并被从DNA上移除。其中一种表观遗传学修饰就是DNA甲基化,长期以来研究人员发现,DNA甲基化模式在癌细胞中经常会被改变,基于这个原因,改变DNA甲基化的药物或许就非常有潜力作为癌症的潜在疗法。
【3】Cancer Immunol Immuno:CD16xCD33双特异性杀伤细胞衔接器(BiKE)在小儿AML和双表型ALL患者中的潜在免疫治疗作用
doi:10.1007/s00262-021-03008-0
急性白血病是儿童中诊断出的最常见的恶性肿瘤,约占儿童癌症诊断的30%,绝大多数(80%) 患有急性淋巴细胞白血病(ALL),而其余的被诊断为急性髓性白血病(AML)。其中,大约25%的双表型或双系ALL表达髓系特异性抗原CD33,因此,CD33+白血病患者标志着一个高危人群,迫切需要新的策略来促进免疫系统克服恶性肿瘤而不增加进一步危及生命的毒性。自然杀伤(NK)细胞是先天免疫系统的关键参与者,能够进行免疫监视,其活性的调节受一系列激活和抑制受体的调节,最终,这些受体的平衡将决定NK细胞是否会对健康或恶性的“自我”保持沉默(耐受)、自身反应性或细胞毒性(同种异体反应性)。
不同的研究已经证明了通过CD16和单克隆治疗性抗体操纵NK细胞的治疗潜力,在这种情况下,双特异性抗体代表了一类新的单克隆抗体,可将肿瘤细胞上的表面抗原与细胞毒性淋巴细胞(如NK细胞)的效应细胞受体连接起来,从而产生抗肿瘤作用。为了更有效地将NK细胞引导至白血病靶点,研究者设计了一种完全人性化的双特异性杀伤细胞接合器。 CD16xCD33 BiKE包含两个抗体片段,第一个识别CD16 (FcγRIII),第二个针对骨髓分化抗原CD33,它们共同触发抗体依赖性细胞介导的细胞毒性。针对CD33+靶标的CD16信号传导是NK细胞特异性的,并且专门针对CD33+细胞,因此,抗体通过CD16直接触发NK细胞活化,显着增加NK细胞的细胞毒性和细胞因子的产生。此外,通过这种方式,CD16xCD33 BiKE已被证明有可能克服KIR信号传导的抑制作用,并改善NK细胞介导的成人AML原始细胞裂解。该研究评估了CD16xCD33 BiKE是否可以增强NK细胞对CD33+原发性儿童ALL和AML细胞的激活。
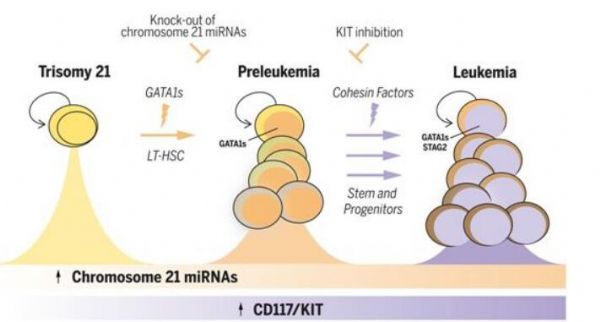
唐氏综合征白血病发生中的细胞来源。
图片来源:Science, 2021, doi:10.1126/science.abf6202。
【4】Science:揭示唐氏综合征患儿白血病发生的细胞来源
doi:10.1126/science.abf6202
唐氏综合征(Down syndrome)是一种遗传性疾病,由人类早期发育过程中细胞分裂的随机错误引起,导致21号染色体多了一个拷贝。这个额外的拷贝是导致与该综合征相关的发育变化和身体特征的原因,包括对白血病的易感性。患有唐氏综合征的儿童在其生命的头五年内患骨髓性白血病的风险增加了150倍。然而,21号染色体的额外拷贝容易导致白血病的机制仍不清楚:白血病在胎儿发育过程中开始产生的确切血细胞类型,以及导致这种细胞成为白血病前期的基因改变,在此之前是未知的;此外,必须在儿童时期积累的使白血病前期转变为急性白血病的额外突变也是未知的。
在一项新的研究中,加拿大研究人员首次在临床前模型中绘制出患有唐氏综合征的婴儿白血病的起源和发展过程,为未来预防这种癌症铺平了道路。相关研究结果发表在2021年7月9日的Science期刊上,论文标题为“Mapping the cellular origin and early evolution of leukemia in Down syndrome”。论文共同通讯作者、玛嘉烈公主癌症中心的John Dick博士解释说,“在一个人被诊断出患有这种疾病之前,已经发生了一连串的细胞事件。你不知道在那一刻哪个事件先发生了,你只知道它已经发生了。我们的模型第一次让我们了解了这种人类白血病的过程。最终,我们也许能够通过在其最早阶段---白血病前期---进行治疗,以防止其发展为全面的白血病。”
通过使用一种临床前模型,包括来自人类组织生物库的人类唐氏综合征细胞,以及由玛嘉烈公主癌症中心的Elvin Wagenblast博士和Eric Lechman博士开发的用于改变人类造血干细胞基因的增强型CRISPR/Cas9方法,这些作者着手绘制这一特定白血病演变过程中涉及的步骤。
短暂性白血病前期(transient preleukemia)是一种经常发生在患有唐氏综合征的新生儿身上的独特情况,它可以在出生后几天到几个月内自发消失,也可以在四年内通过在一些人身上获得额外的突变而转变为急性骨髓性白血病。
【5】Nat Cancer:新研究揭示CAR-T细胞疗法是否有效治疗儿童白血病
doi:10.1038/s43018-021-00207-7
在一项新的研究中,来自英国伦敦大学学院的研究人员在研究利用CAR-T细胞疗法治疗儿童白血病患者的有效性时,发现一小部分称为干细胞记忆T细胞(stem cell memory T-cell)的T细胞可能在这种治疗是否成功方面起着关键作用。他们指出干细胞记忆T细胞似乎对一开始就摧毁癌症和长期免疫监视都很关键,利用这种特性可能改善CAR-T细胞疗法的设计和性能。相关研究结果近期发表在Nature Cancer期刊上,论文标题为“Clonal expansion of T memory stem cells determines early anti-leukemic responses and long-term CAR T cell persistence in patients”。
论文第一作者、伦敦大学学院大奥蒙德街儿童健康研究所的Luca Biasco博士解释说,“在临床试验中,我们在年轻的白血病患者身上看到了一些非常令人鼓舞的结果,然而仍然不清楚为什么CAR-T细胞在一些患者身上长期持续存在,阻止了癌症的复发,而其他患者仍然有很高的复发风险。为了确保白血病治疗的效果,任何CAR-T细胞疗法必须对身体识别和清除癌细胞的方式产生长期的影响。在这项研究中,我们试图找到控制这些长期反应的T细胞的起源和性质。”
在CAR-T细胞疗法中,称为T细胞的免疫细胞经过基因改造后,使得它们的表面含有一种叫做嵌合抗原受体(CAR)的分子,这样它们就可以利用CAR分子特异性地识别癌细胞。
这些作者评估了参与CARPALL一期研究的患者体内的CAR-T细胞,该一期研究使用了伦敦大学学院癌症研究所和伦敦大学学院大奥蒙德街儿童健康研究所开发的一种称为CAT-19的新CAR分子,用于治疗患有急性淋巴细胞白血病(ALL)的儿童。
这些作者比较了治疗两年多后血液中仍可检测到CAR-T细胞的患者与治疗后1至2个月内失去CAR-T细胞的患者的CAR-T细胞。利用一种称为 “插入位点条形码(insertion site barcoding)”的技术,他们能够研究不同类型的CAR-T细胞在患者体内的命运。
【6】Blood:新研究揭示唐氏综合征患儿具有更高的急性淋巴白血病的患病风险
doi:10.1182/blood.2018890764
急性淋巴细胞白血病(ALL)是儿童中最常见的癌症。此外,对于患有21三体综合征(唐氏综合症)的儿童来讲,他们患ALL的几率比没有唐氏综合症的儿童高10到20倍。
对此,来自贝勒医学院的Karen R. Rabin博士和Philip J. Lupo博士一直在研究合一差异背后的原因。 Rabin说:“尽管这种现象自1950年代就已被人们认识,但我们不知道为什么他们患白血病的风险也会增加。”在这项研究中, Rabin及其同事发现了新线索。“我们进行了全基因组关联研究(GWAS),使我们能够寻找唐氏综合症患儿与患有ALL的唐氏综合症患儿之间的遗传差异,这可能解释了唐氏综合症导致ALL患病几率上升的原因。”
为了进行GWAS类型的研究,研究人员需要大量的病例和对照。用了几年时间,最终他们合并了约500例(唐氏综合症/ ALL)和超过1000例对照(唐氏综合症/无ALL)。先前的GWAS研究已经研究了部分遗传变异,这些遗传变异会增加一般儿童期(患有唐氏综合症的儿童)患ALL的风险。这些研究已经确定了几种与ALL的较高风险相关的基因。
“我们发现了四种与唐氏综合症患儿ALL风险密切相关的遗传变异。虽然先前已经在非唐氏综合症患儿的ALL研究中发现了这些基因,但在我们的研究中其作用要强得多”。
图片来源:VashiDonsk/Wikipedia
【7】3个月响应率81%,12个月生存率76%!NEJM公布CAR-T疗法治疗儿童白血病重磅结果!
doi:10.1056/NEJMoa1709866
一项全球、多中心的CAR-T细胞疗法的关键二期临床实验结果于近日发表在New England Journal of Medicine上,也正是该研究促使了美国FDA批准首个基因/细胞疗法。该疗法名为tisagenlecleucel,通过使用基因工程化的患者自身白细胞靶向并杀伤癌细胞。该疗法已于2017年7月被FDA批准用于治疗儿童急性淋巴细胞白血病(ALL),该疾病是最常见的儿童癌症。
“Stephan课题组及其在CHOP的研究团队领导了这项研究,该研究成功表明在不同地方制备并使用该疗法是非常有效的。” Pulsipher说道,他是CHLA儿童癌症和血液疾病中心血液和骨髓移植分部带头人。“为了这项研究,我们和许多同仁一起合作,发现CAR T细胞疗法不仅在全球多点通用,而且疗效和安全性都很棒。”
Pulsipher还是小儿血液和骨髓移植协会主席,与Grupp及文章主要作者Shannon Maude(CHOP)以及英国、加拿大、欧洲、日本、澳大利亚的科学家们,携手研究赞助商诺华一起组织并执行了该研究。该研究总计在全球25个地区、11个国家进行。
这篇研究报道了75例3-21岁之间患复发性或者难治疗的B细胞ALL病人的数据。61%的病人在异体骨髓干细胞移植后复发,已无其他疗法可选。为了对比,该文章引用了另一个FDA批准的用于治疗复发或难治愈的ALL的疗法:它的响应率为20%,中位生存期为13周。
doi:10.1016/j.cell.2016.12.011
在一项新的研究中,来自美国西北大学费恩柏格医学院的研究人员发现一种罕见的致命性儿童白血病的基因促发物,并且鉴定出一种阻止白血病细胞增殖的靶向分子疗法。相关研究结果于2017年1月5日在线发表在Cell期刊上,论文标题为“Therapeutic Targeting of MLL Degradation Pathways in MLL-Rearranged Leukemia”。
混合谱系白血病(mixed lineage leukemia, MLL)主要影响新生儿和婴儿。在被确诊后,不到10%~20%的MLL儿童存活的时间不会超过5年。美国每年有300例MLL产生。
论文通信作者、西北大学费恩柏格医学院生物化学与分子遗传学教授、儿科教授Ali Shilatifard说,“在过去20年,我们一直在实验室中尝试着在分子水平上理解MLL易位如何导致儿童患上这种罕见的严重性的白血病以至于我们能够利用这种信息开发一种有效地治疗这种癌症的方法。如今,我们取得一项至关重要的突破。”Shilatifard、他的研究生Kevin Liang和他们的同事们对这项突破极其充满期待,并且正在试图将他们的发现转化为治疗儿童白血病的方法。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。