2021年9月17日Science期刊精华
来源:本站原创 2021-09-19 23:49
2021年9月19日讯/生物谷BIOON/---本周又有一期新的Science期刊(2021年9月17日)发布,它有哪些精彩研究呢?让小编一一道来。1.Science:揭示SAA蛋白向肠道髓样细胞提供视黄醇以促进肠道适应性免疫机制doi:10.1126/science.abf9232在一项新的研究中,来自美国德克萨斯大学西南研究中心的研究人员鉴定出血清淀粉样
2021年9月19日讯/生物谷BIOON/---本周又有一期新的Science期刊(2021年9月17日)发布,它有哪些精彩研究呢?让小编一一道来。

图片来自Science期刊。
1.Science:揭示SAA蛋白向肠道髓样细胞提供视黄醇以促进肠道适应性免疫机制
doi:10.1126/science.abf9232
在一项新的研究中,来自美国德克萨斯大学西南研究中心的研究人员鉴定出血清淀粉样蛋白A(serum amyloid A, SAA)-视黄醇复合物的一个受体,它介导视黄醇摄取到肠道髓样细胞。此外,他们还确定了这种视黄醇摄取机制是如何影响维生素A依赖性免疫的。相关研究结果发表在2021年9月17日的Science期刊上,论文标题为“Serum amyloid A delivers retinol to intestinal myeloid cells to promote adaptive immunity”。
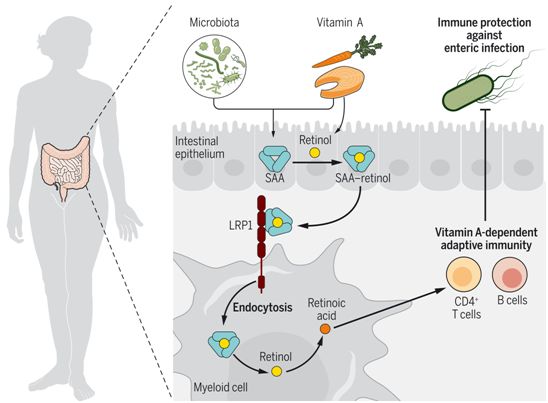
SAA蛋白通过LRP1将视黄醇输送到肠髓细胞,促进适应性免疫。图片来自Science, 2021, doi:10.1126/science.abf9232。
对这些小鼠的研究显示,SAA及其LRP1受体促进了体内肠道髓样细胞对视黄醇的吸收,并促进了将视黄醇转化为视黄酸的酶的表达。因此,SAA和髓样细胞表达的LRP1是维生素A依赖性适应性免疫产生所必需的,包括B和T细胞归巢到肠道和IgA产生。最后,他们发现在免疫后,SAA和LRP1促进了对肠道感染的免疫力。
综上所述,这些作者确定了SAA是视黄醇结合蛋白,将视黄醇输送到产生视黄酸的肠道髓样细胞。SAA-视黄醇复合物与肠道髓样细胞表面的LRP1结合并被内吞,为视黄酸的酶促产生提供视黄醇。因此,SAA和LRP1促进了肠道中维生素A依赖性适应性免疫的产生,增强了免疫后对肠道感染的抵抗力。
2.Science:炎症在促进胰腺瘤发生的同时限制组织损伤
doi:10.1126/science.abj0486
胰腺导管腺癌(PDAC)是一种以预后不良为特征的肿瘤,代表了炎症和激活的癌基因之间合作的一个独特的例子。胰腺癌经常在慢性胰腺炎的背景下发生,与炎症微环境有关。正如许多实验模型中的大量证据所支持的那样,当发生在胰腺炎的背景下时,KRAS(胰腺癌的普遍致癌驱动因素)的突变会导致肿瘤加速发展,并诱发肿瘤性前体病变(neoplastic precursor lesion)的出现,如腺泡-导管化生(acinar-to-ductal metaplasia)和可以演变成浸润性肿瘤的胰腺上皮内瘤(pancreatic intraepithelial neoplasia)。
值得注意的是,在没有癌基因激活的急性和慢性胰腺炎期间,肿瘤前胰腺改变,特别是腺泡-导管化生,已经被发现,这表明炎症除了致癌转化外,还有其他作用。为了更好地理解炎症过程和胰腺肿瘤发生之间的关系,来自美国德克萨斯大学MD安德森癌症中心的研究人员使用不同的小鼠模型来研究应对急性胰腺损伤的暂时性炎症事件的长期影响,以及炎症消退如何与激活的癌基因合作,在正常上皮细胞中驱动肿瘤进展。相关研究结果发表在2021年9月17日的Science期刊上,论文标题为“Epithelial memory of inflammation limits tissue damage while promoting pancreatic tumorigenesis”。
通过研究不同小鼠模型中炎症对正常胰腺上皮细胞的影响,这些作者发现在完全缓解后很长一段时间内,暂时性炎症事件促使胰腺上皮细胞与致癌的Kras合作诱导胰腺肿瘤。事实上,从一次急性炎症中恢复后,胰腺上皮细胞显示出一种持久的适应性反应,这种适应性反应与导致多种基因表达程序(包括在癌症进展过程中激活的胚胎程序)激活的持续性转录和表观遗传重编程有关。在促进肿瘤发展的同时,这种对组织损伤的适应性有利于在随后的炎症事件中迅速获得腺泡-导管化生。这种腺泡细胞的快速去分化程序,在刺激持续的时间内,让组织迅速和明显地完全恢复,代表了一种生理机制:通过快速减少酶原的产生来限制组织损伤,否则会助长进一步的损伤和炎症。因此,暴露于初始炎症的胰腺组织对后续炎症发作的反应明显减弱,组织损伤有限。鉴于化生损伤是由丝裂原活化蛋白激酶(MAPK)信号的激活介导的,这些作者证实Kras的激活突变,通过MAPK组成性信号维持不可逆的腺泡-导管化生,对胰腺炎症引起的组织损伤有保护作用。
3.Science:癌细胞出人意料地利用遗传技巧逃避免疫系统
doi:10.1126/science.abg5784
肿瘤抑制基因长期以来一直被认为能够阻止细胞生长,防止癌细胞扩散。科学家们认为,这些基因的突变从而使肿瘤不受控制地蓬勃发展。如今,在一项新的研究中,来自美国布莱根妇女医院和丹娜-法伯癌症研究所的研究人员发现了许多这些存在缺陷的肿瘤抑制基因的一个令人惊讶的新作用。他们报告说,100多个发生突变的肿瘤抑制基因可以阻止免疫系统发现和摧毁小鼠体内的恶性肿瘤细胞。相关研究结果发表在2021年9月17日的Science期刊上,论文标题为“The adaptive immune system is a major driver of selection for tumor suppressor gene inactivation”。论文通讯作者为布莱根妇女医院遗传学家Stephen Elledge博士。
图片来自Pixabay/CC0 Public Domain。
这篇新论文提供了一些答案。Elledge及其研究团队探究了7500个基因的影响,包括已知与人类癌症有关的基因。在这些与癌症有关的基因中,有三分之一或更多的基因一旦发生突变,就会触发阻止免疫系统根除肿瘤的机制,而且往往是以一种组织特异性的方式进行的。
4.Science:将银纳米颗粒整入到希瓦氏菌中,可以显著提高微生物燃料电池的电流和功率
doi:10.1126/science.abf3427
在一项新的研究中,来自美国加州大学洛杉矶分校的研究人员在开发微生物燃料电池(microbial fuel cell)---利用天然细菌从废水中的有机物中提取电子以产生电流---方面迈出了一大步。 这一突破性进展发表在2021年9月17日的Science期刊上,论文标题为“Silver nanoparticles boost charge-extraction efficiency in Shewanella microbial fuel cells”。
这些作者专注于希瓦氏菌属(Shewanella)细菌,这类细菌因其能量产生能力而被广泛研究。它们可以在所有类型的环境---包括土壤、废水和海水---中茁壮成长,而不管氧气水平如何。希瓦氏菌属细菌天然地将有机废物分解成更小的分子,电子是这一代谢过程的副产物。 当这些细菌在电极上以薄膜的形式生长时,一些电子可以被捕获,形成一种可以发电的微生物燃料电池。 然而,由奥奈达希瓦氏菌(Shewanella oneidensis)驱动的微生物燃料电池以前没有从这种细菌中捕获足够的电流,这就使得该技术在工业上缺乏足够的实用性:很少有电子能够快速移动到足以逃离这种细菌的膜并进入电极以提供足够的电流和功率。
为了解决这个问题,这些作者在由一种氧化石墨烯组成的电极上添加了银纳米颗粒。这些纳米颗粒释放出银离子,这些细菌利用它们的代谢过程中产生的电子将释放出的银离子还原为银纳米颗粒,然后使之整合到它们的细胞中。一旦进入这些细菌体内,银纳米颗粒就像微型传输线一样,捕捉它们产生的更多电子。
随着电子传输效率的大幅提高,所产生的银浸泡的希瓦氏菌属细菌薄膜向外部电路输出了80%以上的代谢电子,产生了每平方厘米0.66毫瓦的功率--是以前基于微生物的燃料电池的最佳值的两倍以上。
5.Science:重大进展!发现一种新型的切割RNA的III型CRISPR-Cas系统
doi:10.1126/science.abk2718
在一项新的研究中,荷兰代尔夫特理工大学的Stan Brouns博士及其研究团队发现了一种新型的可以切割RNA的III型CRISPR-Cas系统。这一发现预计将为基因研究和生物技术的新应用开发提供许多机会。相关研究结果于2021年8月26日在线发表在Science期刊上,论文标题
为“The gRAMP CRISPR-Cas effector is an RNA endonuclease complexed with a caspase-like peptidase”。
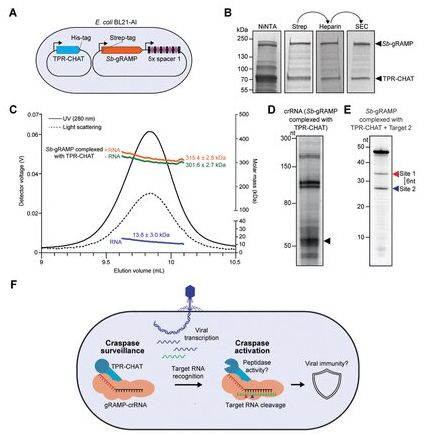
图片来自Science, 2021, doi:10.1126/science.abk2718。
Brouns说,“自2006年以来,我们一直试图了解CRISPR-Cas系统,并且不断发现CRISPR-Cas的新变体,可以用于重要的应用。例如,CRISPR-Cas9允许对细胞中的DNA进行非常精确的编辑。这在研究界掀起了一场真正的革命,例如在研究遗传性疾病方面。CRISPR-Cas系统 也被证明是众所周知的PCR检测冠状病毒的一种令人关注的替代选择。我们如今发现的这种新的III型CRISPR-Cas系统不是在DNA上起作用,而是在RNA上起作用,这提供了一系列新的可能性。”
6.Science:揭示植物复杂性的进化脉冲
doi:10.1126/science.abi6984
陆生植物的进化是以生殖结构的复杂性增加为标志的。Leslie等人在对整个古生物学记录中的陆地植物化石和现存植物的研究中分析了这种增加的时间模式。生殖复杂性在两个相距甚远的脉冲中增加,这与生殖生物学的关键创新相对应:种子起源于泥盆纪晚期,开花植物起源于几乎2.5亿年后的白垩纪中期。在花的起源之后,开花植物的形态学复杂性迅速扩大。与动物形态多样性的许多方面在进化史上的早期扩展相比,植物的大多数复杂性是相对较晚实现的。
7.Science:探究mRNA-1273疫苗诱导的抗SARS-CoV-2变体抗体的持久性
doi:10.1126/science.abj4176
令人担忧的SARS-CoV-2变体的进化,对实现疫苗诱导的免疫力构成了潜在的障碍。Pegu等人研究了SARS-CoV-2变体,包括B.1.351(Beta)和B.1.617.2(Delta)变体,是如何影响接受Moderna mRNA-1273疫苗接种的少数人的免疫反应。通过分析第一疫苗系列中第二次注射6个月后获得的血清,这些作者发现,针对所有测试的SARS-CoV-2变体的中和抗体滴度持续存在。然而,针对B1.351变体的中和抗体在6个月后大幅下降,一些人的中和活性很弱,在某些情况下甚至没有。这些数据可能有助于指导有关额外强化疫苗接种的公共卫生政策。
8.Science:我国科学家从结构上提出SAM介导的线粒体TOM核心复合物组装的新见解
doi:10.1126/science.abh0704
β桶外膜蛋白(β-OMP)在线粒体、叶绿体和革兰氏阴性菌中发挥着重要作用。进化保守的复合物,如线粒体分拣与组装复合物(SAM),介导了β-OMP的组装。在一项新的研究中,Wang等人研究了SAM介导的外膜转运酶(TOM)核心复合物的组装。SAM完全折叠的Tom40和SAM-Tom40/Tom5/Tom6复合物的低温电镜结构在大约3埃的分辨率下显示,Sam37主要通过静电相互作用让成熟的Tom40保持稳定,从而促进随后的TOM组装。这些结果支持了β桶切换模型,并为β桶复合物的组装和释放提供了结构上的新见解。
9.Science:非人类灵长类动物接种mRNA-1273疫苗后的免疫保护相关因素
doi:10.1126/science.abj0299
免疫保护的相关因素是用于衡量疫苗诱导的免疫原性和保护的临床终点。Corbett等人研究了非人灵长类动物(NHP)对不同剂量的mRNA-1273(Moderna)疫苗的免疫反应,以提供一系列的免疫反应和保护结果。他们确定,循环的刺突蛋白特异性抗体与阻止SARS-CoV-2在呼吸道中的复制相关。被动转移的NHP抗体足以介导对遭受SARS-CoV-2挑战的仓鼠的保护,这突显了抗体是机制上的相关因素。保护下呼吸道需要较低的血清抗体浓度,这可能解释了为什么目前大多数疫苗对严重的下呼吸道疾病都非常有效。减少上呼吸道感染所需的较高的抗体阈值对加强疫苗接种限制传播有潜在的影响。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


