Journal for ImmunoTherapy of Cancer: VEGFR-2重定向的CAR-T细胞会因可溶性VEGF-A受体结合竞争而功能受损
来源:生物谷 2021-08-22 23:38
一些晚期治疗难治性血液系统恶性肿瘤对CD19靶向嵌合抗原受体(CAR)-T细胞的前所未有的反应导致监管部门迅速批准并加速了T细胞工程领域的癌症免疫治疗努力。
一些晚期治疗难治性血液系统恶性肿瘤对CD19靶向嵌合抗原受体(CAR)-T细胞的前所未有的反应导致监管部门迅速批准并加速了T细胞工程领域的癌症免疫治疗努力。然而,迄今为止,CAR-T细胞治疗上皮衍生实体瘤的临床获益有限,一个主要的挑战是鉴定在肿瘤上广泛表达的实体肿瘤抗原(TA),这些抗原不会冒着靶内毒性和肿瘤外毒性的风险。事实上,虽然CD19主要是B细胞受限,但在健康组织中也有少量固体TAs没有被发现。受限的T细胞归巢是另一个障碍,以及T细胞跨血管进入肿瘤床的内皮迁移障碍,此外,一系列免疫抑制因子,如程序性细胞死亡配体-1 (PD-L1)可以在肿瘤微环境(TME)中上调,合理设计的组合疗法和协同工程策略提供了通过TME重编程或/和直接增强T细胞功能来支持实体瘤CAR治疗的潜力。
图片来源:http://dx.doi.org/10.1136/jitc-2020-002151
由肿瘤血管内皮细胞表达的TA对CAR治疗具有临床意义,因为它们的基因组稳定性和循环T细胞的可及性,以及它们在多种肿瘤类型中的表达,在这项研究中,研究者试图探索第二代(2G)鼠CAR-T细胞对血管内皮生长因子受体-2 (VEGFR-2)的疗效的局限性,其中包含充分表征的单链可变片段DC101。
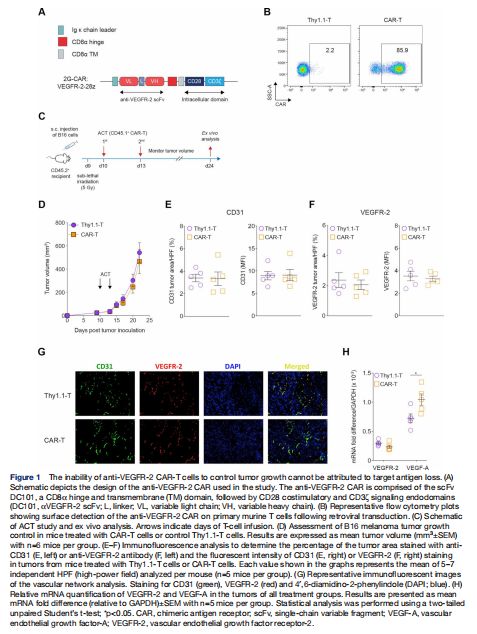
抗VEGFR-2 CAR-T细胞无法控制肿瘤生长不能归因于靶抗原丢失 图片来源:http://dx.doi.org/10.1136/jitc-2020-002151
研究者使用了包含抗VEGFR-2 scFv DC10129的2G CAR,融合到CD8α的铰链和跨膜结构域,然后是CD28和CD3ζ的内结构域。通过可溶性重组mVEGFR-2-hIgG-Fc融合蛋白染色评估,用编码CAR(或对照T细胞的Thy1.1)的逆转录病毒有效地改造原代鼠T细胞(>80%转导),转导后第7天进行流式细胞术分析。肿瘤细胞移植后第10天和第13天,8×106 CD45.1+抗 VEGFR-2-CAR-T细胞在B16黑色素瘤荷瘤小鼠中的过继转移未能控制肿瘤生长,研究者首先质疑TA丢失是否可能是CAR-T细胞对肿瘤控制不佳的原因。然而,过继细胞转移(ACT)后B16 肿瘤的免疫荧光分析表明情况并非如此,因为CD31和VEGFR-2的分布和密度在CAR-T细胞和对照Thy1.1-T细胞治疗组中相似。于是,研究者进一步评估了VEGF-A基因表达水平,并观察到CAR-T细胞与对照T细胞治疗小鼠的肿瘤显着增加,这与VEGFR-2基因表达没有差异。

可溶性VEGF-A减弱CAR-T细胞与VEGFR-2+内皮细胞的粘附 图片来源:http://dx.doi.org/10.1136/jitc-2020-002151
为了评估在VEGF-A存在下CAR-T细胞粘附的变化,研究者首先建立了一项体外测定,其中荧光标记的T细胞沉积在bEnd3 (VEGFR-2+)或H5V (VEGFR- 2-)内皮细胞,观察到Thy1.1-T细胞对bEnd3和H5V细胞的粘附水平较低。相比之下,抗VEGFR-2 CAR-T细胞与bEnd3内皮细胞强烈结合,但与H5V细胞结合较差。对1×105 CAR-T细胞和Thy1.1-T细胞的重复测定显示,在可溶性VEGF-A存在下,CAR-T细胞与bEnd3细胞的粘附显着下降,然而,bEnd3暴露于VEGF-A并没有改变细胞内粘附分子-1(ICAM-1)、血管细胞粘附分子-1(VCAM-1)和 VEGFR-2的表达水平。研究者询问了结构数据库并确定了人抗VEGFR-2抗体ramucirumab,它已被证明在空间上阻碍了VEGF-A与VEGFR-2的结合,因为它与DC101具有序列相似性: 重链同源性约为65%,轻链同源性约为58%,使用ramucirumab单抗与VEGFR-2的结构域(D)3复合物(PDB ID 3S36)的同源性建模,预测了VEGFR-2:DC101结构,然后将其叠加在人VEGFR-2:VEGF-A异源四聚体(PDB ID 3V2A)的结构上。叠加预测和实验结构显示,在该模型中DC101与VEGFR-2的D2和D3结合并进入它们之间的凹槽,并且DC101的残基51-IEDKSNNYFIS-61与VEGF-A占据相同的空间,因此,计算模型表明结合的VEGF-A可能会在空间上阻碍DC101 scFv与VEGFR-2的结合。

在可溶性VEGF-A存在的情况下,CAR与VEGFR-2抗原的结合和抗原诱导的CAR-T细胞效应器功能受损 图片来源:http://dx.doi.org/10.1136/jitc-2020-002151
该研究试图通过实验测试可溶性VEGF-A是否会干扰基于DC101 scFv的CAR与mVEGFR-2的结合,因此,将抗VEGFR-2 CAR-T细胞与重组mVEGFR-2-hIgG-Fc混合,该重组mVEGFR-2-hIgG-Fc已与VEGF-A或预组装的VEGF-A/抗VEGF-A抗体复合物预孵育。正如预期的那样,在任何测试条件下,对照Thy1.1-T细胞都不与mVEGFR-2-hIgG-Fc结合,抗VEGFR-2 CAR-T细胞强烈结合mVEGFR-2-hIgG-Fc,但如果mVEGFR-2-hIgG-Fc与VEGF-A预孵育,则不会结合,此外,与VEGF-A/抗VEGF-A抗体复合物混合的抗VEGFR-2 CAR-T细胞与可溶性 mVEGFR-2-hIgG-Fc强结合。研究者在相同条件下估了抗VEGFR-2 CAR-T细胞效应器对板捕获靶抗原(即VEGFR-2)的作用,抗VEGFR-2 CAR-T细胞在靶抗原存在下分泌高水平的干扰素γ(IFN-γ)和白介素2(IL-2),而在可溶性VEGF-A存在下细胞因子的产生减弱,但在VEGF-A/抗VEGF-A抗体复合物存在下则不然。
该研究未涉及通过抗VEGF-A抗体阻断肿瘤促进过程的相对贡献,然而,开发靶向VEGFR-2其他不受可溶性配体损害的结构域的scFv有必要进一步探索针对肿瘤血管系统的CAR疗法。 这项研究是第一个因与可溶性配体竞争而导致CAR功能受损的例子,研究者为使用促进 CAR-T细胞粘附和重新编程TME以增强CAR-T细胞适应性和肿瘤控制的组合疗法提供了理论依据。(生物谷 bioon)
参考文献
Evripidis Lanitis et al. VEGFR-2 redirected CAR-T cells are functionally impaired by soluble VEGF-A competition for receptor binding. Journal for ImmunoTherapy of Cancer (2021 Aug 13) doi:http://dx.doi.org/10.1136/jitc-2020-002151
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。