可切除早期肺癌辅助治疗里程碑!美国FDA授予罗氏Tecentriq(泰圣奇)优先审查:显著延长无病生存期!
来源:本站原创 2021-08-13 01:37
这是首次,一种癌症免疫疗法可延长许多可切除早期肺癌患者的生命,而不会复发。

2021年08月12日讯 /生物谷BIOON/ --罗氏(Roche)近日宣布,美国食品和药物管理局(FDA)已受理抗PD-L1疗法Tecentriq(泰圣奇,通用名:atezolizumab,阿替利珠单抗)的一份补充生物制品许可申请(sBLA):用于肿瘤表达PD-L1≥1%的非小细胞肺癌(NSCLC)患者,作为手术和铂类化疗后的辅助治疗。目前,FDA正在实时肿瘤学审查(RTOR)试点项目下对该sBLA进行审查,该项目旨在探索更有效的审查流程,以确保尽早为患者提供安全有效的治疗。FDA预计将在2021年12月1日前做出审批决定。
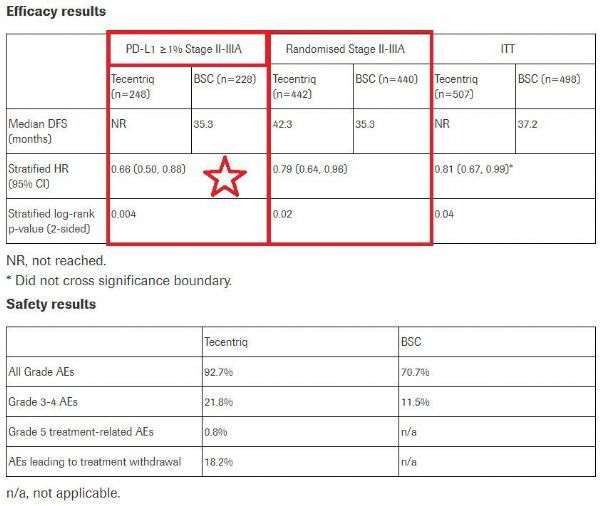
该sBLA基于3期IMpower010研究的结果,相关数据已于今年5月公布。值得一提的是,IMpower010是第一个也是唯一一个3期研究表明与最佳支持护理(BSC)相比一种癌症免疫疗法可提高可切除早期肺癌患者的无病生存期(DFS)。同时,Tecentriq是第一个在早期肺癌辅助治疗中获得阳性3期结果的癌症免疫疗法。具体数据为:在肿瘤表达PD-L1(≥1%)的II-IIIA期NSCLC患者中,在手术和含铂化疗之后,Tecentriq用于辅助治疗时与最佳支持护理(BSC)相比,将疾病复发或死亡风险降低了34%(HR=0.66,95%CI:0.50-0.88)。在该人群中,Tecentriq组的中位DFS尚未达到,BSC组为35.3个月。该研究中,Tecentriq的安全数据已其已知的安全概况一致,没有发现新的安全信号。
辅助治疗的目的是降低复发的风险,并提供最佳的治愈机会。尽管如此,大约一半的I-III期NSCLC患者在接受治愈为目的治疗后最终会出现疾病复发。辅助铂类化疗是目前用于完全切除后疾病复发风险很高的早期NSCLC(IB-IIIA其)患者的标准护理方案。与观察相比,辅助铂类化疗使5年生存率适度提高4-5%。因此,该领域对新的辅助治疗方案存在着重大未满足医疗需求。
凭借IMpower010研究的里程碑式成果,Tecentriq是首个癌症免疫疗法,能够帮助许多可切除的早期肺癌患者延长生命,而不会复发,特别是在PD-L1阳性患者群体中。
罗氏首席医疗官兼全球产品开发负责人Levi Garraway医学博士说:“早期非小细胞肺癌急需新的治疗方案,以帮助目前手术后复发的近50%的患者。Tecentriq是第一个在辅助治疗肺癌中显示出临床意义的癌症免疫疗法,我们正在与FDA密切合作,尽快将这一重大进展带给患者。”
IMpower010临床数据(点击图片,查看大图)
IMpower010是一项全球性、多中心、开放标签、随机3期研究,评估IB-IIIA期NSCLC(UICC第7版)患者在进行外科手术切除和最多4个疗程以顺铂为基础的辅助化疗之后,将Tecentriq、BSC用于辅助治疗的疗效和安全性。该研究中,1005例患者以1:1的比例随机分配,最多接受16个疗程的Tecentriq或BSC。主要终点:PD-L1阳性II-IIIA期患者群体、所有随机化II-IIIA期患者群体、意向性治疗(ITT)IB-IIIA期患者群体中,由研究调查员确定的无病生存期(ivDFS)。关键次要终点包括:整个研究群体、ITT IB-IIIA期NSCLC患者群体中的总生存期(OS)。结果显示:
——在肿瘤表达PD-L1≥1%的II-IIIA期NSCLC患者中:在手术和化疗之后,将Tecentriq用于辅助治疗时,与BSC相比,将疾病复发或死亡风险显著降低了34%(HR=0.66;95%CI:0.50-0.88;p=0.004)。在该患者群体中,Tecentriq治疗组中位DFS尚未达到,BSC组中位DFS为35.3个月。
——在所有随机化II-IIIA期NSCLC患者中:中位随访32.2个月后,与BSC相比,Tecentriq将疾病复发或死亡风险降低了21%(HR=0.79;95%CI:0.64-0.96;p=0.02)。在该患者群体中,与BSC组相比,Tecentriq组中位DFS延长了7个月(42.3个月 vs 35.3个月)。
该研究中,Tecentriq的安全数据与其已知的安全概况一致,未发现新的安全信号。在整个研究群体中,Tecentriq组有92.7%、BSC组有70.7%的患者发生不良事件(AE);Tecentriq组有21.8%、BSC组有11.5%的患者发生3级或4级AE。Tecentriq组有0.8%的患者发生5级AE。正如预期的那样,在化疗后进行长达一年的辅助治疗时,与BSC相比,Tecentriq导致了更多的不良事件。
该研究将继续对患者进行随访,以便对整个意向性治疗(ITT)患者群体中的DFS进行计划性分析,包括IB期患者,这些患者在此次分析时数据未超过阈值;在中期分析时,总体生存期(OS)数据还不成熟。

肺癌是全球癌症死亡的主要原因。每年有176万人死于该疾病;这意味着全世界每天有4800多人死亡。肺癌可大致分为两大类:非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)。NSCLC是最常见的类型,约占所有病例的85%。目前,大约一半的早期肺癌患者在手术后仍然经历癌症复发。在肺癌扩散之前及早治疗,可能有助于防止疾病复发,并为患者提供最佳的治愈机会。
此前,Tecentriq已在各种类型的肺癌中显示出有临床意义的益处,在肺癌方面已获批多个治疗适应症:(1)Tecentriq是第一个被批准用于一线治疗广泛期小细胞肺癌(ES-SCLC)成人患者的癌症免疫疗法,与化疗(卡铂+依托泊苷)联合用药;(2)治疗NSCLC方面有4个治疗适应症,作为单药疗法、或与靶向疗法和/或化疗联合治疗。Tecentriq有3种给药方案,可灵活选择每2周、3周、4周给药一次。
Tecentriq属于PD-(L)1肿瘤免疫疗法,靶向结合肿瘤细胞和肿瘤浸润免疫细胞上表达的一种名为PD-L1的蛋白,阻断其与PD-1和B7.1受体的相互作用。通过抑制PD-L1,Tecentriq可以激活T细胞,该药有潜力作为癌症免疫疗法、靶向药物和各种癌症化疗方案的基础配伍疗法。
截至目前,Tecentriq在美国、欧盟及世界其他国家批准,作为单药疗法、以及联合靶向疗法和/或化疗,治疗多种类型的非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)、某些类型的转移性尿路上皮癌(mUC)、PD-L1阳性转移性三阴性乳腺癌(mTNBC)、肝细胞癌(HCC)。在美国,Tecentriq还被批准联合Cotellic(cobimetinib)和Zelboraf(vemurafenib)治疗BRAF V600突变阳性的晚期黑色素瘤。
罗氏为Tecentriq制定了广泛的开发计划,包括多项正在进行和计划进行的III期研究,涉及多种类型的肺癌、泌尿生殖系统癌、皮肤癌、乳腺癌、胃肠道癌、妇科癌和头颈癌。这包括Tecentriq单独用药或与其他药物联合治疗的研究。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->