肺动脉高压(PAH)新药!美国FDA批准强生Uptravi(赛乐西帕)静脉制剂:用于暂时无法口服的患者!
来源:本站原创 2021-07-31 02:03
Uptravi静脉制剂将确保暂时无法口服的患者维持不间断治疗。
PAH(图片来源:narayanahealth.org)
2021年07月30日讯 /生物谷BIOON/ --强生(JNJ)旗下杨森制药近日宣布,美国食品和药物管理局(FDA)已批准Uptravi(selexipag,赛乐西帕)静脉注射剂(IV),用于治疗目前已处方口服疗法但暂时无法接受口服疗法、WHO功能分级II-III的肺动脉高压(PAH,WHO组I)成人患者。在PAH患者中,由于疾病的进展性,应避免中断治疗。此次批准的新制剂,允许暂时无法口服治疗的PAH患者进行不间断的治疗。
Uptravi是一种选择性前列环素IP受体激动剂。Uptravi片剂于2015年首次获得美国FDA批准治疗PAH,用于延缓疾病进展并降低因PAH住院的风险。Uptravi IV是一种治疗选择,可使患者避免短期治疗中断,使患者能够继续接受Uptravi治疗。
确保不间断治疗对PAH患者而言很关键。因为即使是由于暂时不能口服药物而导致的相对短期的PAH治疗中断,也会对患者的健康产生重大的负面影响,研究已证实Uptravi持续治疗可显著改善患者的长期预后。用Uptravi IV来防止Uptravi治疗中断,对PAH患者而言是一个重要的治疗选择。
此次批准基于一项前瞻性、多中心、开放标签、单序列交叉3期研究(NCT03187678)的结果。该研究在20例患者中开展,旨在评估PAH患者从稳定剂量Uptravi片剂转向相应剂量Uptravi IV、然后再转回至初始Uptravi片剂剂量的安全性和耐受性。结果表明,在口服Uptravi片剂不可行的情况下,Uptravi IV适合维持短时间连续给药治疗。Uptravi片剂和Uptravi IV之间转换的耐受性良好,没有意外的安全性发现。Uptravi IV的不良反应与Uptravi片剂的不良反应相似,但输液部位反应除外。前列环素相关的不良反应包括头痛、腹泻、恶心、呕吐、下颚疼痛、肌痛、四肢疼痛、潮红和关节痛。
该研究的结果于今年早些时候发表于国际医学期刊《Respiratory Research》,详见:Temporarily switching from oral to intravenous selexipag in patients with pulmonary arterial hypertension: safety, tolerability, and pharmacokinetic results from an open-label, phase III study。
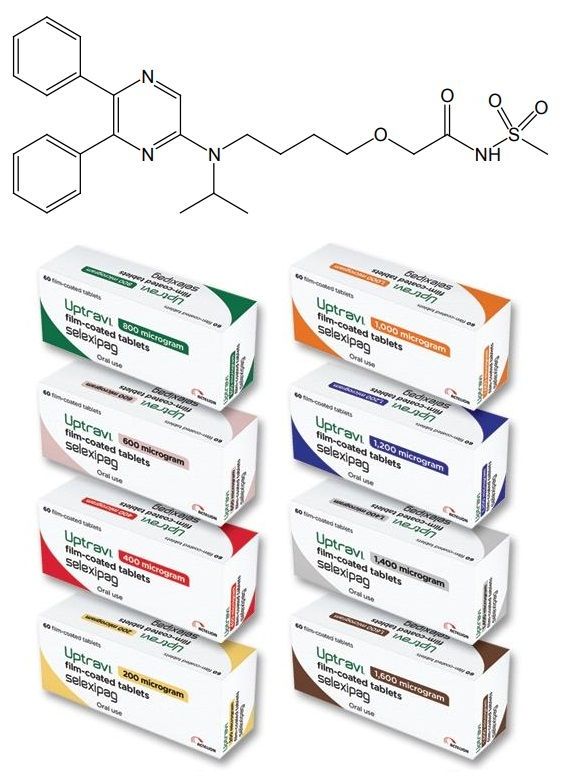
selexipag化学结构式(图片来源:Uptravi片剂说明书)
Uptravi IV上述研究的资深作者、德克萨斯大学西南医学中心肺动脉高压计划主任和内科副教授Kelly Chin表示: “鉴于这种疾病的进展性,维持治疗对于控制PAH非常重要。然而,有时患者可能无法服用口服药物。对于服用Uptravi的患者,用Uptravi IV桥接Uptravi片剂的短期暂时中断可以维持治疗效果,避免在重新开始治疗后需要改变治疗或重新滴定Uptravi片剂。”
杨森研发公司肺动脉高压全球治疗区域负责人Neil Davie博士表示:“今天对于依赖Uptravi的患者来说是一个重要的日子,因为这种新的静脉制剂满足了这些患者目前尚未满足的需求。作为我们致力于投资研究和了解Uptravi潜力相关科学的一部分,我们受到这一批准的启发,并自豪地为推进PAH患者的治疗选择和护理铺平道路。”(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


