研究揭示人源NMDA受体的门控机制和全新小分子结合位点
来源:脑智卓越中心 2021-06-29 12:18
6月29日,《神经元》在线发表了研究性论文《人源GluN1-GluN2A NMDA受体的门控机制和一个全新小分子结合位点》。该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、上海脑科学与类脑研究中心、神经科学国家重点实验室竺淑佳研究组完成。该研究解析了一系列人源NMDA(N-methyl-D-asparti
6月29日,《神经元》在线发表了研究性论文《人源GluN1-GluN2A NMDA受体的门控机制和一个全新小分子结合位点》。该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、上海脑科学与类脑研究中心、神经科学国家重点实验室竺淑佳研究组完成。该研究解析了一系列人源NMDA(N-methyl-D-aspartic acid,即N-甲基-D-天冬氨酸)受体GluN1-GluN2A亚型与不同小分子化合物结合的高分辨率冷冻电镜的结构,探究了受体在不同小分子结合下的门控机制,并发现了一个全新的小分子结合位点。该研究丰富了NMDA受体的神经药理学特性,为深入理解NMDA受体结构和功能之间的联系提供了新的分子机制。
NMDA受体作为一类重要的兴奋性离子型谷氨酸受体,在神经系统发育形成与突触可塑性中发挥重要功能。NMDA受体通常由两个结合甘氨酸的必需亚基GluN1和两个结合谷氨酸的可变GluN2亚基(2A-2D)组成异源四聚体离子通道蛋白,其功能异常与中枢神经系统和精神疾病(如抑郁症、精神分裂症、帕金森病和阿尔兹海默症等)有密切的关联性。这些神经与精神疾病给患者及家属带来痛苦,是亟须解决的重要临床难题。因此,深入研究NMDA受体在生理状态下的构象与功能,并揭示全新的小分子结合位点,对于靶向NMDA受体功能异常的新药研发具有重要意义。
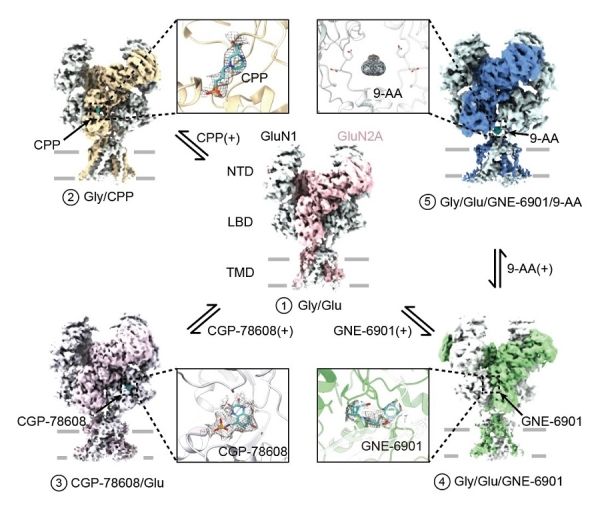
研究通过冷冻电镜解析了一系列高分辨率的处于不同生理状态下GluN1-GluN2A NMDA受体结构(图1)。科研人员引入一对半胱氨酸交联,使受体处于更激活状态,并发现GluN1亚基和GluN2A亚基的配体结合域二聚体有向内旋转的构象变化,验证了之前的功能及动力学模拟研究。
研究人员分别使用高亲和力的GluN2A亚基的竞争性抑制剂CPP和GluN1亚基的竞争性抑制剂CGP-78608,来模拟的受体抑制关闭的状态。与激动剂结合的受体结构对比发现,配体结合域整体处于被打开的构象。随着配体结合域的构象打开,铰链区失去对门控通道结构域的牵引,进而使得门控通道处于关闭状态。为探究变构调节机制,研究人员进一步使用GluN2A亚基特异的正性变构调节剂GNE-6901与GluN1-GluN2A蛋白结合。此前研究发现,该小分子通过作用在由GluN2A亚基组成的NMDA受体上,可以促进CA1锥体神经元的兴奋性突触后电位进而改善脑部功能。冷冻电镜解析的GNE-6901结合的NMDA受体结构分析发现,小分子结合在GluN1与GluN2A亚基配体结合域间二聚体中引起构象变化,使得受体的门控通道进一步处于相对开放的构象。
研究在NMDA受体上首次发现一个全新的小分子结合位点。研究人员使用开放通道抑制剂9-AA与受体结合并解析了三维结构,发现9-AA小分子处于受体跨膜区门控通道的连接域处,完全不同与此前功能实验预测的传统通道抑制剂结合位点。为了验证小分子的作用机制,科研人员通过电生理实验证实了在GluN1和GluN2A的连接域处的一对谷氨酸的突变会影响小分子在受体上的作用,进而给小分子在此处的结合提供了功能验证。该工作丰富了NMDA受体的结构和药理学研究,完整阐释了其作为离子通道的门控机制,为药物设计、筛选及新药研发提供了重要的理论依据(图2)。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


