PNAS:为何化疗药物地西他滨仅对一部分患者有效?科学家阐明其中的缘由!
来源:本站原创 2021-05-28 20:51
2021年5月28日 讯 /生物谷BIOON/ --DNA甲基转移酶抑制剂(DNMTis,DNA-methyltransferase inhibitors),诸如阿扎胞苷和地西他滨,通常在临床上被用来治疗骨髓增生异常综合征(MDS)和急性骨髓性白血病(AML),地西他滨能激活内源性逆转录病毒(ERVs)的转录,从而就能通过对细胞中双链RNAs(dsRNAs)
2021年5月28日 讯 /生物谷BIOON/ --DNA甲基转移酶抑制剂(DNMTis,DNA-methyltransferase inhibitors),诸如阿扎胞苷和地西他滨,通常在临床上被用来治疗骨髓增生异常综合征(MDS)和急性骨髓性白血病(AML),地西他滨能激活内源性逆转录病毒(ERVs)的转录,从而就能通过对细胞中双链RNAs(dsRNAs)作用来诱导机体产生免疫反应,然而,ERV dsRNAs的转录后调节机制目前研究人员并不清楚。
化疗药物地西他滨通常能被用来治疗血液癌症患者,但其反应率相对较低,如今,一篇发表在国际杂志PNAS上题为“Noncanonical immune response to the inhibition of DNA methylation by Staufen1 via stabilization of endogenous retrovirus RNAs”的研究报告中,来自韩国科学技术高级研究院等机构的科学家们就揭示了其中的原因,这或为后期开发新型个体化抗癌疗法来治疗相关类型的癌症提供了新的线索和思路。
图片来源:https://www.pnas.org/content/118/13/e2016289118
这篇研究报告中,研究人员识别出了细胞中特殊的遗传和分子机制到底是如何使得化疗药物地西他滨仅对一些患者有效的;相关研究结果或能帮助临床医生选择更加针对不同患者的治疗性手段。地西他滨,即达克金,其能通过修饰机体DNA从而开启阻断癌细胞生长和复制的基因表达来发挥作用,然而地西他滨的反应率较低(仅能使得30%-35%的患者疾病得到改善),这或许就留下了一些谜题,即为何该药物仅对一部分患者有效,为了阐明其中的原因或机制,文章中研究人员调查了参与调节该药物作用效果的分子介导子。
地西他滨能激活内源性逆转录病毒(ERVs)的产生,从而就会诱导机体免疫反应的产生,ERVs是一种很久之前将自身的休眠拷贝插入到人类基因组中的病毒;从本质上来讲,地西他滨能重新激活这些病毒元件并产生dsRNAs,从而让免疫系统将其视为异物。研究者Yoosik Kim指出,然而,参与该过程的机制,尤其是这些ERV dsRNAs的产生和运输是如何在细胞中被调节的,研究人员并未进行深入研究。因此,为了解释为何地西他滨在某些患者机体中发挥作用,研究人员就调查了其中的关键分子机制。
研究人员使用了基于图像的RNA干扰(RNAi)筛查技术,这是一种相对较新的技术,其能促使基因组中的特定基因被敲除或表达下调,在培养的细胞中或活生物体中进行的大规模筛查技术能帮助调查不同的基因的功能;此外,研究人员还分析了下调基因识别ERV dsRNAs的效应,这些基因或许参与到了对地西他滨的细胞反应过程中。基于这些初步的筛查结果,研究人员进行了更详细的下调筛查分析,通过筛查,他们识别出了两个特殊的基因序列,其或参与到了RNA结合蛋白Staufen1的产生过程中,以及一种并不会产生任何蛋白的RNA序列TINCR的产生过程中,TINCR在帮助机体对药物产生反应过程中扮演着关键的调节性角色;Staufen1能直接与dsRNAs结合并与TINCR一起协同稳定这些dsRNAs。
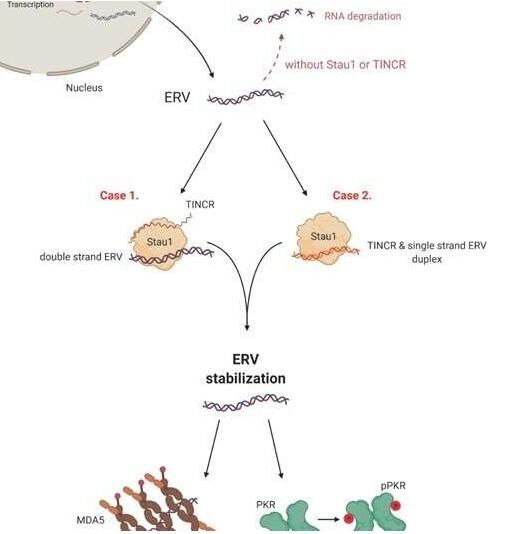
化疗药物地西他滨的分子机制示意图。
图片来源:Yongsuk Ku, et al. Proceedings of the National Academy of Sciences (2021). DOI: 10.1073/pnas.2016289118
如果患者机体中不产生足够的Staufen1和TINCR,随后dsRNA病毒模拟物就会在免疫系统发现它们直线迅速被降解,而且对于癌症治疗而言,这意味着携带较低表达水平序列的患者或许对地西他滨的反应较差,实际上研究人员发现,Staufen1和TINCR低表达的MDS/AML患者并不会因地西他滨疗法而获益。文章第一作者Yongsuk Ku说道,如今我们能够筛选出并不会因疗法而获益的患者并指导这些患者接受不同类型的疗法,而这或许是向开发针对这些患者的特定疗法迈出的关键一步。
由于研究人员使用了来自患者骨髓的样本进行研究,下一步他们将会尝试设计出新的检测技术来识别血样中的问题,因为血液样本更容易从病人那里获取。同时研究人员也计划调查是否这种分析是否能扩展到除上述血液癌症之外的实体瘤患者机体中。
综上,本文研究揭示了ERVs的转录后调节机制,同时还识别出了Stau1-TINCR复合体或能作为一种潜在的靶点来预测DNMTis和其它依赖dsRNAs的药物疗效的潜在目标。(生物谷Bioon.com)
原始出处:
Yongsuk Ku, Joo-Hwan Park, Ryeongeun Cho,et al. Noncanonical immune response to the inhibition of DNA methylation by Staufen1 via stabilization of endogenous retrovirus RNAs, Proceedings of the National Academy of Sciences (2021). DOI: 10.1073/pnas.2016289118
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



