新冠疫情:1.4亿!默沙东口服抗病毒药物molnupiravir治疗轻中度COVID-19门诊患者进入3期临床!
来源:本站原创 2021-04-18 02:06
在症状出现<5天的非住院COVID-19患者中,molnupiravir表现出最大疗效。

2021年04月18日讯 /生物谷BIOON/ --目前,国外新冠肺炎疫情仍在迅速蔓延。根据百度《新型冠状病毒肺炎疫情实时大数据报告》,截止2021年04月18日00时,全球累计确诊超过1.4亿(1.4068亿)例,死亡超过300万(301.5万)例。
近日,默沙东(Merck & Co)与Ridgeback Biotherapeutics公司联合公布了口服抗病毒药物molnupiravir(MK-4482/EIDD-2801)临床项目的最新情况。molnupiravir是一种口服给药的强效核糖核苷类似物,可抑制多种RNA病毒的复制,包括新型冠状病毒(SARS-CoV-2),这是导致COVID-19的病原体。molnupiravir已被证明在SARS-CoV-2的几个临床前模型中具有活性,包括用于预防、治疗和预防传播,在SARS-CoV-1和MERS的临床前模型中也显示出活性。

基于对2项正在进行的评估molnupiravir(每日2次,共5天)治疗COVID-19门诊患者和COVID-19住院患者的安慰剂对照2/3期临床试验(MOVe-OUT,MOVe-IN)的2期剂量发现部分(第1部分)的计划中期数据分析,以及根据先前完成的门诊患者2a期剂量范围研究的数据分析,双方决定继续推进在COVID-19门诊患者中开展的MOVe-OUT研究的3期部分(第2部分),评估每天2次口服800mg剂量的molnupiravir。来自MOVe-IN研究的数据表明,molnupiravir不太可能在COVID-19住院患者中显示出临床益处,这些患者在进入研究前通常症状持续时间较长。因此,双方决定该研究将不推进至3期。
默沙东研究实验室首席医疗官、高级副总裁兼全球临床开发负责人Roy Baynes博士表示:“我们在抗病毒候选药物molnupiravir的临床开发方面继续取得进展。这些研究中剂量发现部分的数据与作用机制一致,并为800mg剂量的抗病毒潜力提供了有意义的证据。根据这项研究的结果,我们正在推进一项针对非住院患者的3期试验项目,该项目战略性地利用我们庞大的临床站点网络,在全球范围内招募合适的患者。”
Ridgeback首席执行官Wendy Holman表示:“我们很高兴molnupiravir继续显示出作为COVID-19非住院患者的潜在治疗方法的前景。来自Ridgebac的EIDD-2801-2003研究(MK-4482-006)和默沙东MK-4482-002研究的数据为molnupiravir的抗病毒活性提供了令人信服的证据。我们期待着MOVe-OUT研究3期部分的启动和完成。”
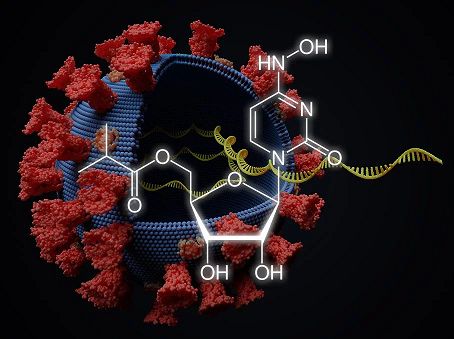
molnupiravir化学结构式(图片来源:scinexx.de)
MOVe-OUT(MK-4482-002)和MOVe-IN(MK-4482-001)研究的更新:
MOVe-OUT是一项正在进行的2/3期、随机、安慰剂对照、双盲、多地点研究,评估口服molnupiravir对经聚合酶链反应(PCR)证实的COVID-19非住院患者的疗效、安全性和药代动力学。MOVe-OUT研究的主要疗效目标是通过从随机分组至第29天期间住院和/或死亡的患者百分比来评估molnupiravir与安慰剂的疗效。
MOVe-OUT研究的第一部分共招募了302名受试者,这些患者在随机分组前7天内出现症状,被分配接受每天口服2次molnupiravir 200mg(n=75)、400mg(n=77)、800mg(n=76),或安慰剂(n=74)。在该研究的第1部分,与安慰剂组相比,合并的molnupiravir治疗组发生住院和/或死亡的患者百分比较低;报告的事件数量不足以提供有意义的临床效果测量。使用定量和定性PCR(一个探索性终点)对MOVe-OUT研究和MOVe-IN研究患者鼻咽和口咽拭子中的SARS-CoV-2进行分析表明,molnupiravir抑制了病毒复制,与安慰剂相比,治疗第5天和第10天病毒RNA较基线水平下降、在治疗结束后第10天和第15天检测不到病毒RNA的受试者比例更高。与200mg和400mg剂量相比,800mg剂量观察到的总体抗病毒作用最大。病毒学终点的这些差异在症状出现<5天的受试者中更为明显。
在MOVe-OUT研究中,接受过至少一剂研究干预的299例患者中,molnupiravir治疗的患者中有6.2%(14/225)、安慰剂治疗的患者中有6.8%(5/74)报告了药物相关的不良事件。在MOVe-IN研究中,接受过至少一剂研究干预的293例患者中,molnupiravir治疗的患者中有11.0%(24/218)、安慰剂治疗的患者中有21.3%(16/75)报告了药物相关的不良事件。迄今为止,来自MOVe-IN研究和MOVe-OUT研究的安全性和实验室数据,没有提供任何证据表明在任何研究剂量下观察到的意外发现或趋势。在这2项试验中,molnupiravir治疗的患者中,没有死亡病例被研究者认为与药物有关,也没有发现导致停药的药物相关不良事件。MOVe-IN研究和MOVe-OUT研究的中期结果,包括病毒学发现和药代动力学分析,已与监管机构共享,并将在即将召开的医学会议上公布。
外部数据监测委员会注意到,亚组分析支持治疗的潜在益处,并建议对MOVe-OUT方案进行修正,以便将入组重点放在病程早期的患者和那些被认为有不良COVID-19结果的高风险患者(例如,老年患者、肥胖患者和糖尿病患者)。根据这些建议,默沙东将修改MOVe-OUT研究的入组标准,将允许的症状持续时间缩短至<5天,并入组至少有一个进展为严重疾病的危险因素的受试者。默沙东计划在4月下旬/5月上旬开始3期部分(第2部分)的患者入组。
MOVe-OUT研究3期部分(第2部分)的最终数据预计将于2021年9月/10月提供。默沙东目前预计,在MOVe-OUT研究取得有利结果的情况下,最早可能于2021年下半年提交molnupiravir的紧急使用授权(EUA)申请。默沙东和Ridgeback公司计划与监管机构分享正在进行的molnupiravir开发项目的进一步发现。此外,默沙东还计划在2021年下半年启动一项临床项目,对molnupiravir进行暴露后预防性评估。(生物谷Bioon.com)
原文出处:Merck and Ridgeback Biotherapeutics Provide Update on Progress of Clinical Development Program for Molnupiravir, an Investigational Oral Therapeutic for the Treatment of Mild-to-Moderate COVID-19
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


