改变临床实践!小野制药Opdivo在日本提交新适应症:辅助(术后)治疗尿路上皮癌(UC)!
来源:本站原创 2021-04-08 01:48
与安慰剂组相比,Opdivo治疗组无病生存期延长一倍。

2021年04月07日讯 /生物谷BIOON/ --小野制药(Ono Pharmaceutical)近日宣布,已在日本提交了一份补充申请,寻求批准抗PD-1疗法Opdivo(欧狄沃,通用名:nivolumab,纳武单抗),作为一种辅助(术后)疗法,用于治疗已接受手术切除的尿路上皮癌(UC)患者。
就在上月底,小野制药合作伙伴百时美施贵宝发布公告称,欧洲药品管理局(EMA)已受理了Opdivo的II类变更申请,并已启动集中审查程序:将Opdivo作为一种辅助(术后)疗法,用于治疗已接受手术切除的高危肌肉浸润性尿路上皮癌(MIUC)患者。如果获得批准,Opdivo将是欧洲治疗MIUC的第一个辅助免疫治疗方案。
尿路上皮癌(UC)是一种始于肾盂、输尿管、膀胱和尿道的肿瘤,其中绝大部分是膀胱癌。组织病理学上,UC占膀胱癌的90%以上。膀胱癌的标准治疗方法是新辅助化疗后进行根治性切除,但据报道,根治性切除后50%以上的患者会复发。由于以转移癌为复发的患者预后很差,因此对术后辅助治疗以预防复发有非常高的医疗需求。
此次申请基于关键3期CheckMate-274试验的结果。这是第一项评估一种免疫疗法辅助治疗MIUC的阳性3期试验。数据显示,无论患者PD-L1表达水平如何,Opdivo辅助治疗均显著延长了无病生存期(DFS)、几乎是安慰剂的2倍。该研究中,Opdivo总体耐受性良好,其安全性与先前报道的实体瘤患者中Opdivo研究一致。
MIUC患者常接受大手术切除膀胱,作为一种挽救生命的措施,但他们的癌症复发的概率仍在50%左右。在CheckMate-274试验中,接受Opdivo治疗的患者疾病无复发生存时间几乎是安慰剂组的2倍。这些具有临床意义的结果有潜力改变医生治疗MIUC的方式,帮助解决手术后对有效、可耐受治疗方案的迫切需求。
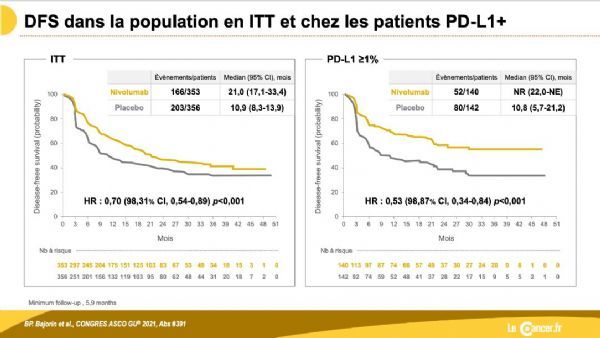
CheckMate-274临床数据(图片来源:lecancer.fr)
CheckMate-274是一项随机、双盲、多中心研究,在接受根治性手术后有高复发风险的MIUC患者中开展。根据患者特点,入组患者可能已在手术前接受过新辅助(术前)化疗,也可能没有。研究中,709例患者以1:1的比例随机分配,接受Opdivo或安慰剂治疗一年。主要终点是所有随机化患者(意向性治疗群体,ITT)和肿瘤表达PD-L1(≥1%)亚组患者中的无病生存期(DFS)。关键次要终点包括总生存期(OS)、非尿路上皮无复发生存期(NUTRFS)、疾病特异性生存期(DSS)。
结果显示:(1)在所有随机化患者(ITT)中,与安慰剂相比,Opdivo辅助治疗使无病生存期几乎延长一倍:安慰剂组中位DFS为10.9个月,而Opdivo治疗组为21.0个月,疾病复发风险显著降低了30%(HR=0.70;98.31%CI:0.54-0.89,p<0.001)。(2)在肿瘤表达PD-L1≥1%的亚组患者中,Opdivo治疗组的中位DFS尚未达到,而安慰剂组为10.8个月(HR=0.53,98.87%CI:0.34-0.84,p<0.001)。
此外,Opdivo在关键次要终点方面也显示出改善,包括非尿路上皮无复发生存期(NUTRFS),定义为患者在膀胱、输尿管或肾盂以外无疾病复发的生存时间。在所有随机化患者中,Opdivo治疗组患者的中位NUTRFS超过2年(24.6个月),而安慰剂组为13.7个月(HR=0.72,95%CI:0.58-0.89)。在肿瘤表达PD-L1≥1%的亚组患者中,Opdivo治疗组的中位NUTRFS未达到,而安慰剂组为10.9个月(HR=0.54,95%CI:0.38-0.77)。
该研究中,Opdivo的安全性与先前报道的实体瘤研究一致。治疗相关不良事件(TRAE)发生率,Opdivo治疗组为77.5%,安慰剂组为55.5%,而3级或4级TRAE发生率分别为17.9%与7.2%。
膀胱癌(图片来源-medscape.com)
膀胱癌是全球第十大最常见癌症,每年约有55万新病例确诊,约有20万人死于该疾病。尿路上皮癌(UC)是最常见的膀胱癌类型,约占所有病例的90~95%。肌肉浸润性尿路上皮癌(MIUC)是一种已扩散到膀胱、输尿管或肾盂的肌肉中的UC。约25%的膀胱癌新病例被诊断为肌肉浸润性疾病,与非肌肉浸润性尿路上皮癌(non-MIUC)相比,预后更差。
大多数UC在早期阶段确诊,早期治疗MIUC的目的是降低疾病复发或扩散到身体其他部位的风险。但复发率和疾病进展率很高,超过50%的MIUC患者在根治性手术后会经历疾病复发,需要更多的术后治疗选择。对于复发为转移癌的患者,预后很差,采用系统治疗时,中位总生存期约为12-14个月。
值得一提的是,CheckMate-274是第一个也是唯一一个3期试验,显示在根治性手术后有高复发风险的肌肉浸润性尿路上皮癌(MIUC)患者中,一种免疫疗法用于辅助(术后)治疗降低了疾病复发风险。
通过将免疫治疗转移到癌症的早期阶段,有机会中断病程,减少复发,并为患者带来更好的预后。截止目前,以Opdivo为基础的治疗方案,已在4项治疗早期癌症的3期临床试验中显示出疗效,包括辅助(术后)治疗膀胱癌、黑色素瘤、食管/胃食管交界处癌、非小细胞肺癌。
Opdivo是一种程序性死亡-1(PD-1)免疫检查点抑制剂,旨在通过阻断PD-1及其配体之间的相互作用,独特地利用人体自身免疫系统帮助恢复抗肿瘤免疫应答。Opdivo于2014年7月在日本率先获得批准,是全球获批的首款PD-1免疫疗法,治疗适应症为黑色素瘤。通过利用人体自身免疫系统对抗癌症,Opdivo目前已成为多种癌症的重要治疗选择。
在日本,小野制药于2014年9月推出Opdivo治疗无法切除的黑色素瘤。此后,Opdivo在日本陆续获批多种癌症适应症,包括:(1)不可切除性、晚期或复发性非小细胞肺癌;(2)不可切除性或转移性肾细胞癌;(3)复发性或难治性经典霍奇金淋巴瘤;(4)复发性或转移性头颈部癌;(5)化疗后病情进展的不可切除性晚期或复发性胃癌;(6)化疗后病情进展的不可切除性晚期或复发性恶性胸膜间皮瘤;(7)辅助治疗黑色素瘤;(8)不可切除性晚期或复发性食管癌;(9)不可切除性晚期或复发性微卫星不稳定高(MSI-H)结直肠癌。
小野制药是Opdivo的最初研发者,该公司于2011年与百时美施贵宝达成合作,授权百时美施贵宝Opdivo除日本、韩国、中国台湾之外的开发和商业化权利。在2014年7月,双方进一步扩大战略合作,开发和商业化多种免疫疗法(包括单药及组合疗法)用于日本、韩国、中国台湾的癌症患者。截至目前,Opdivo在日本、韩国、中国、美国和欧盟等60多个国家获得批准。(生物谷Bioon.com)
原文出处:ONO Submits Supplemental Application for approval for Opdivo® (Nivolumab) to Expand its Use as Adjuvant Therapy of Resected Urothelial Cancer in Japan
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->