突破常规!aSMA+肌成纤维细胞中的I型胶原缺失居然能加速胰腺癌的进展
来源:本站原创 2021-03-23 14:59
aSMA+肌成纤维细胞中的I型胶原缺失 增强免疫抑制并加速胰腺癌的进展
胰腺癌是一种恶性程度很高的消化道恶性肿瘤,约90%为起源于腺管上皮的导管腺癌(Pancreatic ductal adenocarcinoma, PDAC),是预后最差的恶性肿瘤之一,5年预后不足8%1,因此,PDAC也被称为“癌中之王”。
肿瘤微环境(tumor microenvironment ,TME)指肿瘤发生发展过程中所处的局部生物环境,主要包括肿瘤细胞周围的基质细胞及其分泌物,既可以引起基因突变为肿瘤细胞提供条件,又可以协助肿瘤细胞进行信号转导以及侵袭和转移,因此,TME为肿瘤发生发展提供“温床”。PDAC的TME中存在大量致密的基质成分(extracellular matrix, ECM),越来越多的科学家发现ECM具有促使癌细胞生长和转移的重要功能。其中,胶原蛋白约占总ECM质量的90%以上,最显著的是纤维胶原,包括I型胶原(type I collagen, Col1),它构成了PDAC中大部分的ECM。然而,Col1在PDAC进展中的确切作用和机制分子仍不清楚。
近日来自德克萨斯大学安德森癌症中心癌症生物学系Raghu Kalluri团队在Cancer Cell杂志上发表题为Type I collagen deletion in aSMA+ myofibroblasts augments immune suppression and accelerates progression of pancreatic cancer的文章,发现在Kras诱导的自发性小鼠胰腺导管腺癌背景下,肌成纤维细胞中特异性缺失Col1后,免疫抑制增强,疾病进展加速。
doi: 10.1016/j.ccell.2021.02.007
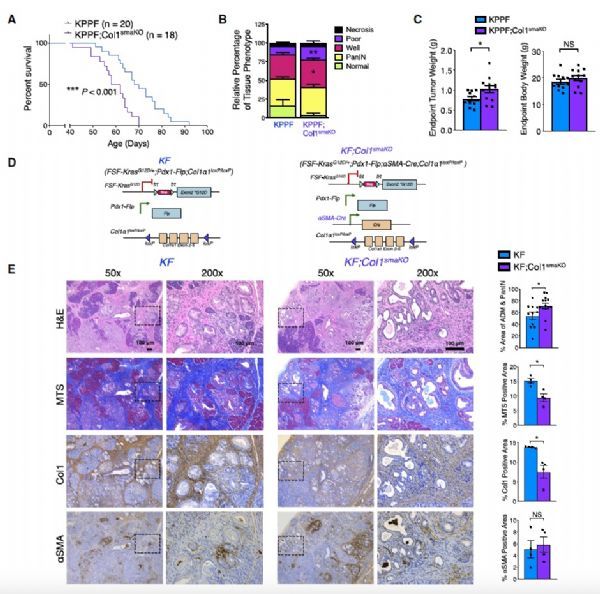
为了阐明Col1在PDAC的发展期间的作用,作者利用双重组酶(dual-recombinase)技术(Flp-FRT重组酶和Cre-loxP系统)在肌成纤维细胞(aSMA+)中敲除Col1a1基因,同时诱导K-rasG12D表达和TP53失活,来观察Col1对PDAC的影响(对照组为KPPF,实验组为KPPF;Col1smaKO)。有趣的是,胶原蛋白含量的减少明显加速了PDAC的进展和恶化,并显著降低了总生存率。
Genetic deletion of Col1 in aSMA+ myofibroblasts accelerates PDAC progression with decreased survival
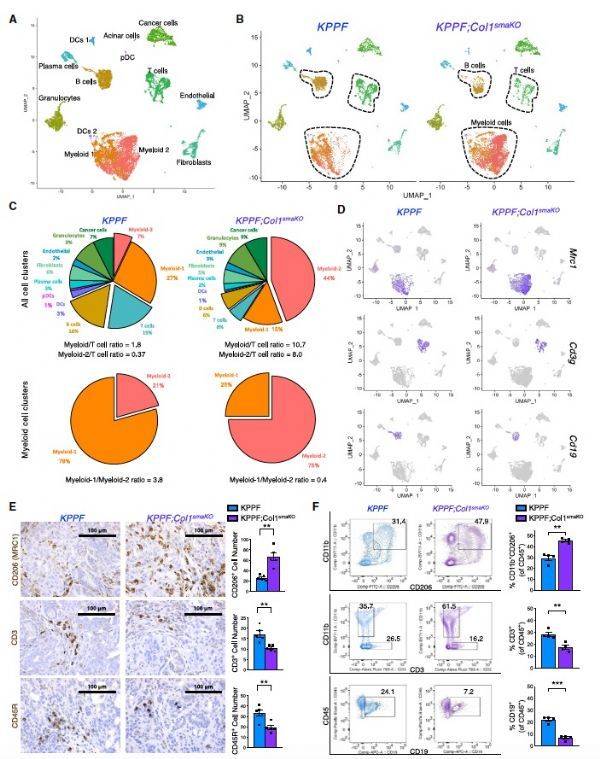
单细胞测序(scRNA-seq)分析显示,在对照组和实验组模型中,成纤维细胞、内皮细胞、粒细胞和癌细胞的细胞数量和簇分布没有重大差异。同样,两种模型在血管密度、周细胞覆盖率或血管完整性方面没有明显差异。重要的是,作者发现CD206+/F4/80+/Arg1+/CCL2+/IL-18+骨髓源性抑制细胞(myeloidderived suppressor cells, MDSCs) 在KPPF;Col1smaKO肿瘤中数量增加,能够抑制B和T淋巴细胞向肿瘤的募集。
Col1 deletion in aSMA+ myofibroblasts impacts immune response in PDAC
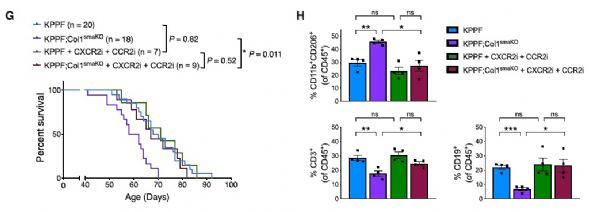
作者进一步发现KPPF;Col1smaKO肿瘤中表达高水平的细胞因子,包括IL-18、CCL2和CXCL5,这些因子均被证明与肿瘤中MDSCs的招募和极化有关。ScRNA-seq分析显示,Il18和Ccl2主要由MDSCs产生,而Cxcl5由癌细胞产生。重要的是,用CXCL5-CXCR2抑制剂(CXCR2 inhibitor, SB-225002)和CCL2-CCR2抑制剂(CCR2 inhibitor,RS-504393)处理KPPF;Col1smaKO小鼠,可以回复较高的免疫抑制水平,显著提高动物的生存。
CXCR2 and CCR2 inhibition reverses tumor progression promoted by Col1 deletion
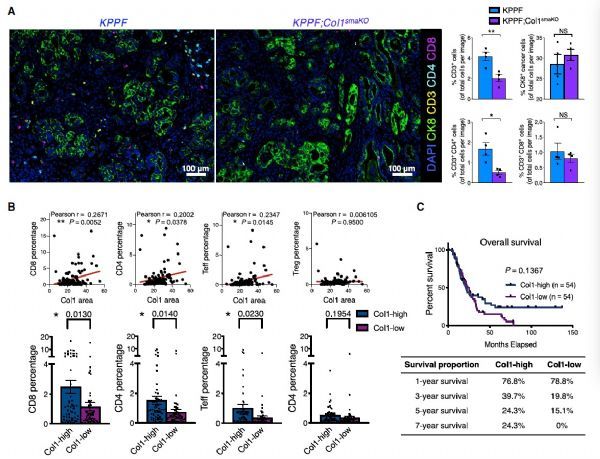
作者进一步在人PDAC样本(n=108)中进行了验证,发现Col1的含量与CD8+ T 细胞,CD4+ T细胞和CD4+ FoxP3-效应T细胞 (Teffs)呈现正相关,但是并不与CD4+ FoxP3+ 调节T细胞(Tregs)有相关性。
Lower Col1 level correlates with less T cells in mouse and human PDAC
综上,该研究表明,肌成纤维细胞产生的I型胶原可以影响肿瘤细胞分泌细胞因子,从而功能性地调节PDAC中的MDSCs的招募和免疫抑制环境,影响PDAC进展。
该研究结果与人类PDAC的临床观察结果一致:存在aSMAhigh/collagen-Ilow 基质,表现出CD206+巨噬细胞数量增加和CD8+ T细胞减少,且总体无进展生存期更差2。该结果也与之前的报告一致,即去除间质成纤维细胞可能会导致小鼠和人类PDAC预后恶化3,4。
一般认为,在PDAC中,ECM一方面为癌细胞的生长提供了有利条件,另一方面ECM中致密的纤维组织压迫PDAC组织内的血管,使抗肿瘤药物无法进入癌组织发挥作用,同时致密的纤维组织阻止了CD8+T细胞、NK细胞等免疫效应细胞在肿瘤组织内的浸润,使肿瘤组织逃避免疫系统的监视1。而这篇文章提出的观点是对常规认识的冲击,也将影响未来的药物开发选择,因为尽管有多个成功的临床前研究,但是到目前为止没有一个抗间质疗法被批准。
原始出处:1. Chen et al., Type I collagen deletion in αSMA + myofibroblasts augments immune suppression and accelerates progression of pancreatic cancer. Cancer Cell. 2021 Feb 25;S1535-6108(21)00109-4.
doi: 10.1016/j.ccell.2021.02.007. PMID: 33667385
2. Madsen, Pancreatic cancer is suppressed by fibroblast-derived collagen I.
https://doi.org/10.1016/j.ccell.2021.02.017
参考文献:
1 Hessmann, E. et al. Microenvironmental Determinants of Pancreatic Cancer. Physiol Rev 100, 1707-1751, doi:10.1152/physrev.00042.2019 (2020).
2 Mahajan, U. M. et al. Immune Cell and Stromal Signature Associated With Progression-Free Survival of Patients With Resected Pancreatic Ductal Adenocarcinoma. Gastroenterology 155, 1625-1639 e1622, doi:10.1053/j.gastro.2018.08.009 (2018).
3 Ozdemir, B. C. et al. Depletion of carcinoma-associated fibroblasts and fibrosis induces immunosuppression and accelerates pancreas cancer with reduced survival. Cancer cell 25, 719-734, doi:10.1016/j.ccr.2014.04.005 (2014).
4 Rhim, A. D. et al. Stromal elements act to restrain, rather than support, pancreatic ductal adenocarcinoma. Cancer cell 25, 735-747, doi:10.1016/j.ccr.2014.04.021 (2014).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。