原发性IgA肾病新药!Nefecon(定点靶向释放布地奈德)在美国申请上市!
来源:本站原创 2021-03-16 00:58
Nefecon在下小肠派尔斑区域靶向释放,与安慰剂相比,显著减少了蛋白尿。
肾脏(图片来源:thehealthsite.com)
2021年03月15日讯 /生物谷BIOON/ --瑞典生物制药公司Calliditas Therapeutics近日宣布向美国食品和药物管理局(FDA)提交了Nefecon(布地奈德)的新药申请(NDA),这是一种新型口服制剂,靶向下调IgA1治疗原发性IgA肾病(IgAN)。该公司正寻求通过505(b)(2)途径申请加速批准。如果获得批准,Nefecon将成为第一个专门设计和批准用于治疗IgAN的疗法。
Calliditas公司首席执行官Renée Aguiar Lucander表示:“这是公司发展的一个关键里程碑,我们期待着与该机构合作。这是第一次专门靶向IgAN的药物被提交给FDA审批,我相信我们提供了一个非常可靠的数据包,基于我们关键的3期试验和2b期试验的成功结果,这2个试验同时满足了主要和关键的次要终点。Calliditas公司长期以来一直致力于开发一种基于精确性和疾病修饰的IgAN治疗方法,这种方法专注于疾病的起源,希望能为成千上万的患者带来帮助,因此今天确实是一个特殊的日子。”
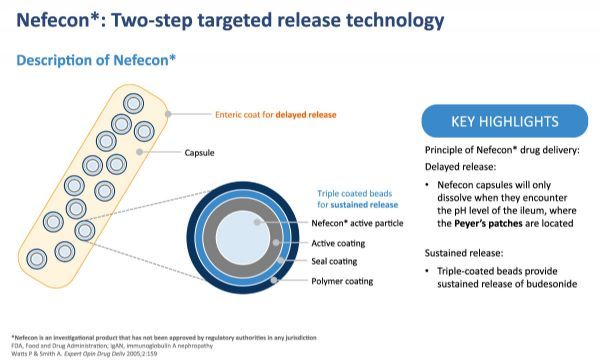
Nefecon是一种口服专利制剂,含有一种强效和广为人知的活性物质——布地奈德(budesonide)——用于靶向释放。根据主要的发病机制模型,该制剂被设计用于将药物输送到疾病起源的下小肠派尔斑区域(Peyer's patch)。Nefecon源自TARGIT技术,该技术允许物质通过胃和肠而不被吸收,并且只有到达小肠下部时才能以脉冲方式释放。
如Calliditas完成的2b期大型试验所示,剂量和优化释放曲线的组合对IgAN患者是有效的。除了有效的局部作用外,使用这种活性物质的另一个优点是它的生物利用度很低,即大约90%的活性物质在到达体循环之前在肝脏中被灭活。这意味着高浓度的药物可以在需要的地方局部应用,但全身暴露和副作用非常有限。
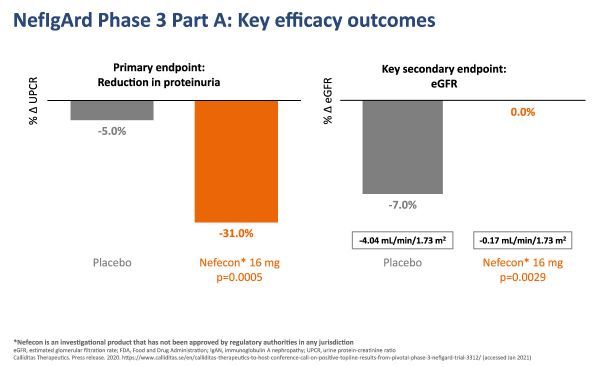
NefIgArd临床试验A部分结果
Calliditas是唯一一家在IgAN的2b期和3期随机、双盲、安慰剂对照临床试验中获得阳性数据的公司。
Nefecon NDA的提交基于NefIgArd关键3期研究A部分的阳性数据。这是一项随机、双盲、安慰剂对照、国际多中心研究,旨在评估Nefecon与安慰剂在200例成人IgAN患者中的疗效和安全性。如前所述,与安慰剂相比,该研究达到了减少蛋白尿的主要终点,并且显示eGFR在9个月时稳定。NefIgArd试验还表明,Nefecon总体耐受性良好,安全性符合2b期结果。提交的资料还包括NEFIGAN 2期试验的临床数据,该试验也达到了NefIgArd研究的主要和次要终点。
Calliditas已经申请了加速批准。加速批准是美国FDA的一个新药审批通道,允许有潜力解决重大疾病未满足医疗需求的药物基于一个替代终点而给予批准。关键3期试验NefIgArd的替代终点是与安慰剂相比蛋白尿的减少,这得到了Thompson A等人于2019年发表的基于临床研究荟萃分析、在临床研究中对IgAN患者进行干预的统计框架的支持。一项旨在提供长期肾脏受益数据的验证性研究已被全面入组,预计将于2023年初公布。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->