生物类似药进入集采提速!修美乐、罗氏强敌环伺
来源:新浪医药新闻 2021-02-20 08:16
春节假期结束后的首个工作日,CDE就发布了一则重磅消息:《生物类似药相似性评价和适应症外推技术指导原则》正式公布,这意味着国内生物类似药进入带量采购的步伐加快。数据显示,我国生物类似药市场规模将于2030年达到589亿元,个别单品将达百亿。业内预测,未来三年内国内预计有30~50多款生物类似药会接连上市,竞争远比PD-1激烈。阿达木单
春节假期结束后的首个工作日,CDE就发布了一则重磅消息:《生物类似药相似性评价和适应症外推技术指导原则》正式公布,这意味着国内生物类似药进入带量采购的步伐加快。
数据显示,我国生物类似药市场规模将于2030年达到589亿元,个别单品将达百亿。业内预测,未来三年内国内预计有30~50多款生物类似药会接连上市,竞争远比PD-1激烈。阿达木单抗、利妥昔单抗、曲妥珠单抗、贝伐珠单抗等重磅生物药强敌环伺。
生物类似药“一致性评价”来了
进入集采再获提速
2月18日,国家药监局药品审评中心(CDE)官网发布《生物类似药相似性评价和适应症外推技术指导原则》,该文件被业内人士称之为生物类似药版的“一致性评价”政策。
指导文件指出,由于生物制品具有分子量大、结构复杂、生物活性对其结构完整性依赖性强、生产工艺复杂等特点,因此为进一步规范和指导生物类似药开发和评价,推动生物医药行业健康发展,指导原则在《生物类似药研发与评价技术指导原则(试行)》的基础上,进一步增补生物类似药相似性评价和适应症外推的指导性建议,旨在为工业界、研发者及监管机构提供技术参考。
值得关注的是,此次的指导文件同去年8月份的征求意见稿相比,对生物类似药的“相似性”进行了具体定义——候选药与已获准注册的参照药整体相似,且在质量、安全性及有效性方面不存在有临床意义的差别。
另外,对于业内普遍关注的适应症外推,文件要求这应在候选药与参照药整体相似的基础上,当直接比对临床试验证明候选药在至少一个适应症上与参照药临床相似的,则可能通过拟外推适应症相关的研究数据和信息的科学论证,以支持其用于参照药中国获批的其他未经直接研究的适应症。适应症外推不能直接获得,需根据药物作用机制特点、已研究适应症与拟外推适应症之间在发病机制、病理生理等方面的异同、以及相似性比对研究数据的充分性进行个案化考虑。
由于生物类似药自身的特殊性,此前业内分析人士就指出,不同于化药可以进行仿制药质量与疗效一致性评价,生物类似药则需要开展相似性评价。在进行全国集采前,化药仿制药需要通过一致性评价。此次,国家医保局正式出台生物类似药的相似性评价和适应症外推技术的指导原则,极大可能是为接下来生物类似药开展带量采购做准备。
生物类似药开展集采的时机成熟吗?
我国生物类似药研发起步较晚,2015年国内生物类似药法规逐渐明朗,单抗的研发从创新申报走向类似药申报,越来越多的企业开始布局生物制品。生物药及生物类似药市场潜在竞争激烈。
目前全国药品集采已经进行到了第四批,今后一年两批也将成为常态。熟知集采规则者都已知晓,带量采购对于新进入者来说,可以节省药品营销和推广成本,增加药品销量和收入,虽然毛利水平低,但是整体上可以提升企业的利润。
生物类似药被纳入带量采购,无疑也能利好新进入者,未来还是少数玩家的市场。国内药企有望通过进口替代或渗透率提高市占率。不过,此前业内对于生物类似药开展带量采购也有不一样的看法。
太平洋证券在去年8月份报告指出,生物类似药壁垒远高于化药仿制药,国产类似药的发展仍处于起步阶段。对比化药在原研专利到期之后仅需进行BE的核心试验,生物类似药不仅需要论证临床和非临床的各项体内体外数据的相似性,还需要进行临床有效性的对比,且适应症的外推不排除需要额外开展试验的可能,其临床开发成本(包括开设临床成本以及购买原研药物成本等)均远高于化药仿制药等。
尽管国内生物类似药开发企业较多,热门靶点呈现扎堆现象,但从全球来看,类似药与原研之间、类似药与类似药之间的替代仍未形成共识,且涉及到适应症外推的核心问题。太平洋证券认为,短期内针对生物类似药的集采仍有较大难度,在当下的竞争环境下决定销售格局的因素将会是各企业的学术推广能力。
不过,在今年2月第四批国采开标后不久,国家医保局副局长陈金甫在国务院政策例行吹风会上就对相关质疑进行了回应,“生物类似药跟化药的仿制药质量评价方式上有差别,但是它有严格的质量标准, 下一步纳入集采是毫无疑义的。一些地方进行了探索,并且中选产品质量是完全可控的....”。
另值得回顾的是,2020年10月9日,国家医保局在答复第十三届全国人大三次会议“关于加快银屑病等疾病医疗保障水平的建议”时明确,正在研究生物制品集中采购相关政策,生物类似药并非集中带量采购的禁区,将适时开展集中带量采购。
农历新年首个工作日,生物类似药的相似性评价和适应症外推技术的指导原则就正式面世,生物类似药纳入集采恐怕只是时间问题了。
生物药集采热门品种预测——
阿达木、利妥昔、曲妥珠...
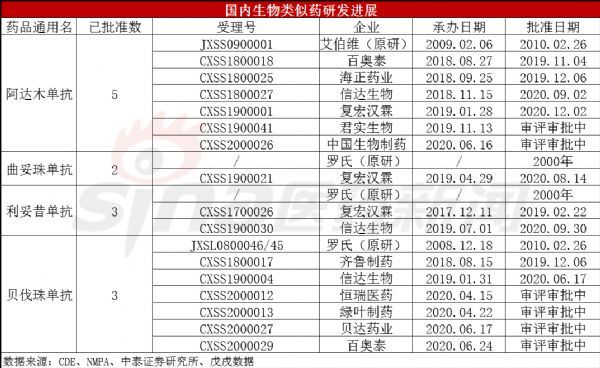
近些年国内企业对于生物类似药的研发热度不减。相关数据统计,中国约有近300个生物类似药处于不同的研发阶段,其中阿达木单抗、利妥昔单抗、曲妥珠单抗、贝伐珠单抗、英夫利昔单抗等属于热门研发品种。
阿达木单抗,包括原研产商艾伯维在内,目前国内获批企业数量最多达到5家,分别有百奥泰、海正药业、信达生物、复宏汉霖,另外君实生物和中国生物制药的生物类似药也在审评审批中。
在专利到期、生物类似药接连获批上市下,2020年修美乐仍然稳居榜首,修美乐再度逼近200亿美元,但是修美乐也有隐忧,增速不容乐观,仅为3.5%。Evaluate Pharma此前预测,到2026年修美乐的全球销售额可能将下降到68.3亿美元。增速较快的K药也被传出将在未来取代修美乐成为“药王”。
弗若斯特沙利文报告显示,中国阿达木单抗生物类似药市场将在2023年增至47亿元,2030年将达到115亿元规模。随着越来越多的生物类似药上市,修美乐在国内的市场份额也将会被逐步挤压,已进入医保目录的阿达木单抗,若再被纳入集采,后续价格将更亲民。
除了最会挣钱的修美乐,罗氏旗下超级重磅肿瘤学“三驾马车”也一直备受关注。其三大王牌药物Rituxan(美罗华,通用名:利妥昔单抗注射液)、Herceptin(赫赛汀,通用名:注射用曲妥珠单抗)和Avastin(安维汀,通用名:贝伐珠单抗注射液)同样面临着专利到期、竞品越来越多的局面。
罗氏的这三款王牌药中,利妥昔单抗、贝伐珠单抗在国内已形成了1+2的竞争格局,其中贝伐珠单抗里还有包括恒瑞医药在内的4家即将获批上市,强敌环伺。另外,根据FDA生物类似药数据库,截至2020年12月,FDA批准的近30个生物类似药中,已有10个针对罗氏三大王牌生物制剂。
罗氏2020年财报显示,三张王牌曲妥珠单抗、贝伐珠单抗、利妥昔单抗2020年销售额均萎缩至50亿瑞士法郎以下,超预期下跌,同比分别-38%、-29%、-35%,2020年累计缩水66亿瑞士法郎。
近日,Evaluate Pharma对2021年热销药物进行了预测,罗氏的美罗华、安维汀纷纷跌出了前十,前十榜单由修美乐、可瑞达、瑞复美、艾乐妥、艾力雅、欧狄沃、喜达诺、必妥维、亿柯、拜瑞妥占据。
在生物类似药的猛烈冲击下,罗氏昔日王牌药也将难继往日辉煌,随着生物类似药相似性评价的到来以及带量采购的开展,未来竞争环境将会更为激烈。
无疑,生物制品集中采购相关政策的出台以及规则会有自己的“玩法”,但带量采购一旦开启,国内市场会面临重新洗牌,生物制品整体产业结构有望得到优化调整,一起拭目以待吧。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。