研究发现RNA互补抑制Cas13活性的分子机制
来源:分子细胞卓越中心 2021-01-27 12:07
近日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)研究员杨荟研究组、美国纪念斯隆凯特琳癌症中心教授Dinshaw J. Patel研究组和分子细胞卓越中心研究员丁建平研究组合作,在Molecular Cell上,在线发表了题为Structural basis for self-cleavage prevention
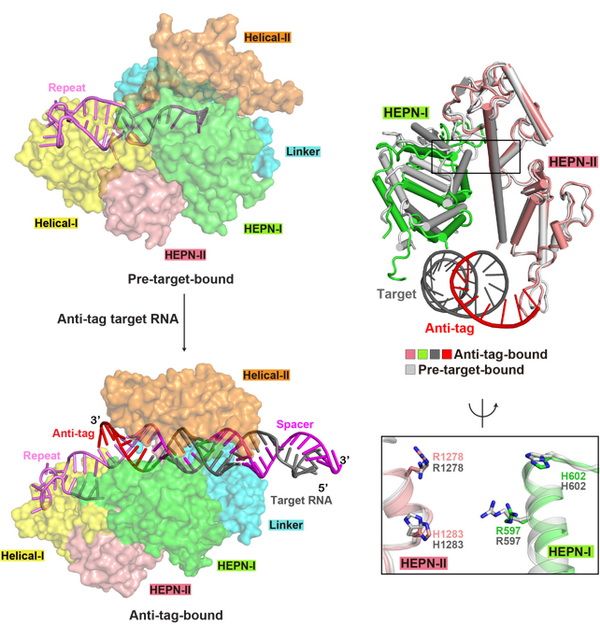
近日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)研究员杨荟研究组、美国纪念斯隆凯特琳癌症中心教授Dinshaw J. Patel研究组和分子细胞卓越中心研究员丁建平研究组合作,在Molecular Cell上,在线发表了题为Structural basis for self-cleavage prevention by tag:anti-tag pairing complementarity in Type VI CRISPR-Cas systems的论文,揭示了目标RNA的anti-tag序列与crRNA重复区形成的RNA双链抑制Cas13a活性的分子机制。
CRISPR-Cas13系统是细菌和古细菌中通过单个Cas蛋白降解外源入侵RNA的获得性免疫系统,相应的效应蛋白Cas13在crRNA介导下序列特异性识别并切割单链RNA,被激活的同时会非特异性切割周围环境中的RNA。Cas13是新兴的RNA编辑工具,在不改变基因组序列的前提下,可以进行RNA水平的敲低、RNA的定点编辑、RNA的定位等,在基因和RNA的功能研究、疾病诊断和靶向治疗等方面具有潜力和应用前景。研究发现,当目标RNA靶向序列的下游可以与crRNA重复区的3’端(tag)连续配对时,对Cas13a的活性有显着抑制作用,防止宿主细胞Cas13 系统的自我靶向,与tag区域配对的序列称为anti-tag。
已有研究阐明了Cas13a对目标RNA特异性识别的分子机制,并发现目标RNA的装载使HEPN结构域从失活变为激活状态。在此基础上,科研人员对Leptotrichia shahii和Leptotrichia buccalis两种Cas13a进行体外酶活和体内RNA干扰研究,发现当目标RNA存在5nt以上anti-tag序列时,Cas13a对目标RNA和周围环境中的RNA的切割活性显着被抑制,对大肠杆菌细胞的RNA干扰活性显着降低。科研人员获得了含有8nt长度anti-tag序列的RNA与LshCas13a复合物的冷冻电镜结构,发现目标RNA的靶向区与crRNA间隔区形成RNA双链,同时目标RNA的anti-tag序列与crRNA的tag区形成的RNA双链。与已有结构比较发现,含有anti-tag序列的目标RNA的结合,引起Cas13a结构域的相对移动,使Cas13a呈现出与正常目标RNA装载前后均不相同的构象。Tag:anti-tag双链的形成,阻碍了HEPN结构域活性中心关键氨基酸的靠近,使HEPN结构域保持失活状态,抑制了Cas13a对目标RNA和周围环境中RNA的切割活性,影响在大肠杆菌细胞RNA干扰的效果。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


