Nature论文详解!揭示细胞如何“吃掉”自己的液体组分
来源:本站原创 2021-01-26 23:55
2021年1月26日讯/生物谷BIOON/---自噬是细胞捕获和降解自身功能障碍或多余的成分进行降解和回收的一个基本细胞过程。最近的研究表明,通过相分离形成的液滴在细胞中具有一系列重要功能。德国、挪威和日本研究人员的国际合作揭示了这些液滴如何通过自噬被捕获的机制,以及液滴如何作为促进细胞质自噬结构产生的平台起作用。两个世界的相遇自噬是一种对人类健康起关键作用
2021年1月26日讯/生物谷BIOON/---自噬是细胞捕获和降解自身功能障碍或多余的成分进行降解和回收的一个基本细胞过程。最近的研究表明,通过相分离形成的液滴在细胞中具有一系列重要功能。德国、挪威和日本研究人员的国际合作揭示了这些液滴如何通过自噬被捕获的机制,以及液滴如何作为促进细胞质自噬结构产生的平台起作用。
两个世界的相遇
自噬是一种对人类健康起关键作用的细胞内降解途径,几十年来一直吸引着细胞生物学家的关注,最终日本东京工业大学特聘教授Yoshinori Ohsumi因揭示这一过程的机制而于2016年获得诺贝尔生理学或医学奖。近来,在快速推进的研究中,观察到自噬可以降解相分离形成的液滴,液滴被认定为细胞的重要结构成分。但这种对液滴的“自噬”是如何发生的,目前尚不清楚。
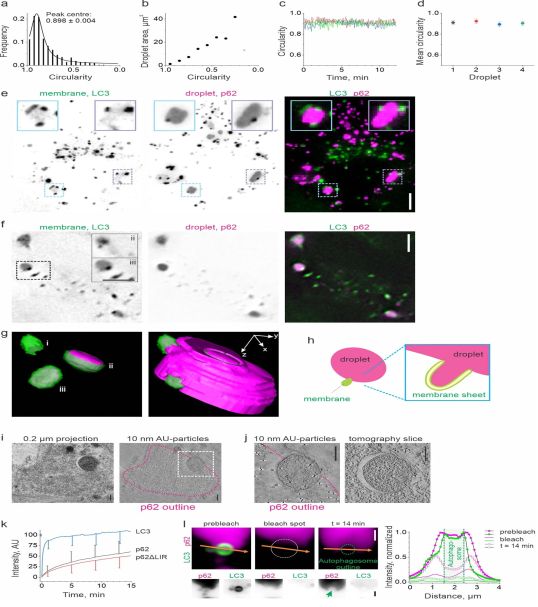
图片来自Nature, 2020, doi:10.1038/s41586-020-2992-3。
这个简单而重要的问题促使东京大学的Roland Knorr博士组建了一个由德国哥廷根、挪威奥斯陆和日本东京的研究人员组成的国际团队,其中包括东京工业大学创新研究所的Alexander I. May博士。该团队着手了解自噬体液滴封存的生物学过程,发现自噬和液滴之间存在着复杂的物理机制。他们的研究结果发表在Nature期刊上,代表了人们对自噬体如何捕获细胞物质以及液滴如何在细胞中降解的理解上取得重大突破。这些发现有望为靶向自噬和在神经退行性疾病和其他疾病中观察到的液滴物质异常积累的治疗研究提供参考。
在自噬的第一步中,作为自噬的关键功能结构,隔离膜(isolation membrane)由双层脂质膜组成,形状有点像扁平的网球,它的体积不断增大,弯曲后形成杯状,最终形成一种称为自噬体(autophagosome)的球形结构。自噬体捕获胞浆(cytosol)和其他细胞物质,如液滴,将这些物质与胞浆的其他部分隔离开来,随后这些物质被分解,分解后的组分被细胞循环利用。这些研究人员重点研究了液滴的分离,他们发现这可以用简单而又基本的物理原理来理解。
咬下液滴的一部分
由于表面张力的影响,液滴是球形的,从而让它的表面积最小化。一个液滴能多强地抵抗球形的变形是由液滴的表面张力来定义的,表面张力的数值反映了液滴和周围的胞浆相互排斥的强烈程度。至关重要的是,脂质膜能够位于液滴和胞浆液体之间的界面上,这种现象称为润湿(wetting)。润湿取决于脂质膜有利于与液滴和细胞质相互作用的强度,以及液滴表面张力。
这些研究人员开发出一种考虑了这些物理力量的理论模型,以解释自噬膜如何与液滴相互作用并捕获液滴。他们发现,液滴-隔离膜的形状是由液滴抵抗变形的能力和隔离膜的弯曲倾向之间的竞争所控制的。
May博士解释了物理力量如何决定液滴-隔离膜相互作用的结果:“在自噬的初始阶段,液滴上的隔离膜较小,这意味着它们只有微弱的弯曲倾向。然而,随着膜面积的增加,这些膜变得更容易弯曲---弯曲能量增加。液滴的表面张力决定了它的抗变形能力,如果表面张力足够低,就可以达到一个临界点,在这个临界点上,隔离膜的弯曲能量克服了液滴的表面张力。在这种情况下,液滴的一部分被‘咬断’并被捕获在自噬体内部。如果这个临界点始终没有达到,液滴的表面张力通过克服膜弯曲能量来‘赢得 ’这场竞争,那么隔离膜将沿着液滴表面继续生长,最终吞噬整个液滴。因此,液滴自噬可以被认为是液滴的表面张力和隔离膜的弯曲能量之间的一种拉锯战。”
鉴于这种模型预测了“零碎(piecemeal)”和“完全”自噬之间的这种权衡,这些研究人员开始在活细胞中证实这些发现。他们使用荧光和电子显微镜的前沿技术组合来追踪富含一种名为p62或SQSTM1的蛋白的液滴区室。正如针对低表面张力液滴条件进行建模所预测的那样,较小的隔离膜定位于液滴表面之后,液滴的碎片会被“咬断”。不过,他们需要开发一种创新的控制液滴表面张力的方法,以证实液滴特性对封存的影响。
对自噬的需求
为了解决这个问题,这些研究人员设计了一种最小的合成实验系统,消除了细胞内环境的复杂性。利用这种方法,他们观察到在具有高表面张力的液滴表面上由预先存在的膜自组装出的隔离膜状结构。这种实验装置的可调性使得他们能够降低液滴表面张力,从而测试这对液滴捕获有什么影响。正如这种模型所预测的那样,他们观察到扁平化的隔离膜通过中间阶段的杯状形状转变为类似自噬体的结构,从而从液滴中咬下一部分。这些研究结果共同证实了这种模型的真实性,并证明润湿是支配液滴处自噬体形成的物理机制。
这些结果表明,当涉及到相分离在自噬中的意义时,生物学家仍然只是在探索冰山一角。耐人寻味的是,去年发表在Nature期刊上的另一项由Ohsumi博士、Knorr博士和May博士共同开展的研究已表明,酵母细胞中自噬体形成的位点其实是从未被捕获的液滴。Knorr 博士说,“我非常着迷于发现液滴是一种新的关键的自噬结构。如今,我们想要了解我们观察到的某些类型的液滴被自噬体降解的机制,如p62,但其他类型的液滴则不会如此。”
换个角度看
上面描述的隔离膜弯曲和液滴表面张力之间的简单竞争,认为隔离膜粘在液滴表面时,隔离膜的特性没有改变。这不太可能,这是因为在液滴自噬过程中,隔离膜的每一面都会润湿两种截然不同的液体:液滴或胞浆液体。这些研究人员扩展了他们的模型来解释这一点,发现隔离膜的这种润湿衍生的内在不对称性决定了弯曲方向,从而决定了捕获会遭受降解的物质:要么通过零碎途径进入液滴,要么通过隔离膜远离液滴的生长进入细胞质。这样做的结果是,隔离膜、液滴特性和细胞质状态的特定组合,共同确定液滴作为自噬的靶标,或者反直觉地,作为使周围胞浆自噬的平台。
为了测试这一点,这些研究人员对p62蛋白进行了修饰,使其缺乏一个已知与隔离膜中的蛋白相互作用的特定基序,从而削弱了隔离膜-液滴关联。这种操作产生了根本性的影响:虽然最初观察到隔离膜沿着野生型(未修饰)细胞中的p62液滴生长,但是它们发生弯曲以捕获胞浆,使液滴保持完全完整。因此,液滴特性的微小变化对活细胞中的自噬模式具有关键性的影响,确定了液滴是零碎化还是完全封闭,甚至捕获胞浆物质。
阐明使这一转换的基本物理原理,为我们理解自噬的机制,以及液滴和细胞中润湿等物理原理的作用提供了一个全新的视角。这一认识为一系列关于物理力量在细胞生物学中的意义的新研究奠定了基础,同时也提供了新的线索,有助于理解自噬是如何参与神经退行性疾病和癌症等不易治疗的疾病。(生物谷 Bioon.com)
参考资料:
1.Jaime Agudo-Canalejo et al. Wetting regulates autophagy of phase-separated compartments and the cytosol. Nature, 2020, doi:10.1038/s41586-020-2992-3.
2.Yuko Fujioka et al. Phase separation organizes the site of autophagosome formation. Nature, 2020, doi:10.1038/s41586-020-1977-6.
3.How cells 'eat' their own fluid components
https://phys.org/news/2021-01-cells-fluid-components.html
4.Mechanism of controlling autophagy by liquid-liquid phase separation revealed
https://phys.org/news/2020-02-mechanism-autophagy-liquid-liquid-phase-revealed.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


