重磅级文章聚焦胶质母细胞瘤研究新进展!
来源:本站原创 2021-01-24 22:34
本文中,小编整理了多篇重要研究成果成果,共同聚焦科学家们在胶质母细胞瘤研究领域取得的新进展,分享给大家!【1】Science子刊:一种称为circ2082的环状RNA促进胶质母细胞瘤细胞生长doi:10.1126/sciadv.abc0221就像迪士尼经典动画片《小飞侠》中长不大的彼得潘(Peter Pan)一样,有些细胞永远不会长大。在癌症中,未分化的干细
本文中,小编整理了多篇重要研究成果成果,共同聚焦科学家们在胶质母细胞瘤研究领域取得的新进展,分享给大家!
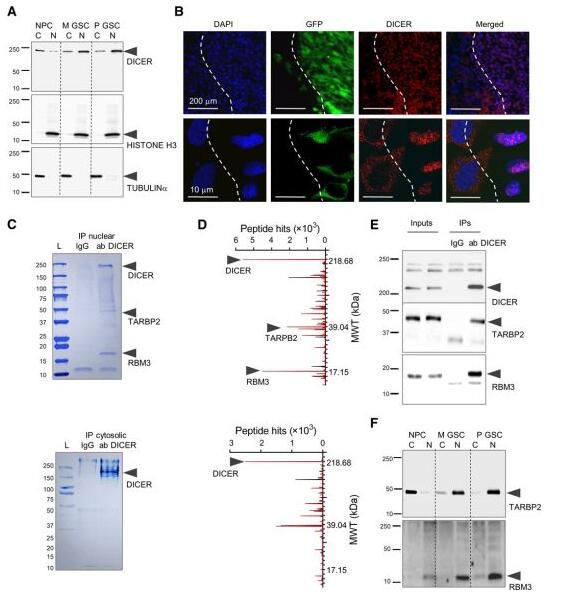
图片来源:Science Advances, 2020, doi:10.1126/sciadv.abc0221
【1】Science子刊:一种称为circ2082的环状RNA促进胶质母细胞瘤细胞生长
doi:10.1126/sciadv.abc0221
就像迪士尼经典动画片《小飞侠》中长不大的彼得潘(Peter Pan)一样,有些细胞永远不会长大。在癌症中,未分化的干细胞可能帮助胶质母细胞瘤等肿瘤变得比其他形式的疾病更具侵袭性。某些基因应当会帮助细胞走向成熟,但不会影响年轻的干细胞。这需要microRNA组(microRNAome )---细胞中产生的所有microRNA---发生重大的改变,microRNA控制着基因在何时和何处开启和关闭。许多microRNA是抑制肿瘤的;在癌症中,microRNA组受到干扰和破坏。
在一项新的研究中,来自美国布莱根妇女医院等研究机构的研究人员精确地指出了一种称为DICER的酶发生的关键变化,这种酶对这种microRNA组产生了一连串的影响。他们鉴定出主要角色circ2082(一种环状RNA)和RBM3(一种RNA结合蛋白),它们与DICER形成复合物,让其停留在胶质母细胞瘤细胞的细胞核中,因此破坏了细胞质中的microRNA组。相关研究结果近期发表在发表在Science Advances期刊上。研究者表示,我们总是试图找到对抗癌症的神灵丹妙药。问题是,它只能攻击少数肿瘤细胞,这是因为其他肿瘤细胞缺乏相应的靶标。我们正在寻找共同的弱点--我们可以靶向的共同弱点是什么?有了这一发现,我们可以靶向上游的一些东西:表观遗传水平上的非常常见的靶标。
【2】Science子刊:将细胞因子和抗体融合在一起有望治疗胶质母细胞瘤
doi:10.1126/scitranslmed.abb2311
在一项新的研究中,来自瑞士苏黎世大学等机构的研究人员发现将细胞因子与抗体融合在一起是一种有效治疗小鼠胶质母细胞瘤的方法。相关研究结果发表在Science Translational Medicine期刊上;在这篇论文中,他们描述了他们的技术,并利用小鼠模型测试了它的效果。
胶质母细胞瘤是一种极其难以治疗的癌性脑肿瘤。手术切除它是困难的,而且充满了副作用,而药物的影响很小。近年来,科学家们尝试使用能提醒免疫系统注意肿瘤存在的药物,但也未能如愿。在这项新的研究中,这些研究人员尝试了另一种方法--将细胞因子与抗体融合在一起,以此来攻击肿瘤。他们希望这两者结合起来,能够促进免疫系统更强烈地攻击肿瘤,并有望消灭它。
【3】Science子刊:利用CSF-1R抑制剂重编程巨噬细胞可增强放疗治疗胶质母细胞瘤的效果
doi:10.1126/scitranslmed.aaw7843
在一项新的研究中,来自瑞士路德维希癌症研究所和洛桑大学等研究机构的研究人员分析了放疗如何改变在胶质母细胞瘤(GBM)中发现的巨噬细胞(一种免疫细胞)的行为,并展示了这些细胞如何可能利用现存的药物加以重编程以抑制这种侵袭性脑癌的持续复发。相关研究结果发表在Science Translational Medicine期刊上。
这项研究详细介绍了放疗如何动态地改变肿瘤相关巨噬细胞(TAM)两种亚型中的基因表达程序,并描述了这些变化如何推动TAM进入一种有助于治疗抵抗性出现和肿瘤生长的状态。Joyce和她的同事们还证实将放疗与每天给送一种靶向巨噬细胞的药物---一种集落刺激因子-1受体(CSF-1R)抑制剂--相结合,可以逆转这种转变,并显著延长GBM小鼠模型的生存期。Joyce说,“这些临床前数据告诉我们,对于接受放疗的GBM患者来说,在治疗方案中加入CSF-1R抑制剂可能起到延长生存期的效果。”
【4】Cell Stem Cell:靶向CD133的CAR-T细胞有望治疗胶质母细胞瘤
doi:10.1016/j.stem.2020.04.008
在一项新的研究中,来自加拿大麦克马斯特大学和多伦多大学的研究人员开发出一种很有前景的免疫疗法,可用于治疗一种致命的成人脑癌形式,即胶质母细胞瘤(glioblastoma)。相关研究结果在线发表在Cell Stem Cell期刊上。这种称为嵌合抗原受体(CAR)T细胞(CAR-T)疗法的免疫疗法涉及在实验室中对来自患者血液的T细胞进行基因改造,使得它们直接靶向结合胶质母细胞瘤细胞表面上的一种称为CD133的特定蛋白,并消灭这些癌细胞。
当在携带人类胶质母细胞瘤的小鼠身上使用时,靶向CD133的CAR-T细胞疗法被认为是成功的,这是因为它减少了这些小鼠的肿瘤负担,提高了它们的生存率。来自这项研究的数据促使在加拿大汉密尔顿市成立了一家名为Empirica Therapeutics的脑癌免疫治疗公司。该公司的目标是在2022年之前,针对CD133特异性的CAR-T细胞疗法和其他疗法在复发性胶质母细胞瘤患者中进行临床试验。
【5】Science子刊:重大进展!重新利用蝎毒中的氯毒素,让CAR-T细胞靶向并杀死胶质母细胞瘤
doi:10.1126/scitranslmed.aaw2672
在一项新的研究中,来自美国希望之城(City of Hope)的研究人员开发并测试了首个利用氯毒素(chlorotoxin, CLTX)引导T细胞靶向脑瘤细胞的嵌合抗原受体(CAR)T细胞(CAR-T)疗法,其中氯毒素是蝎毒中的一种成分。这家研究机构还开放了首个使用这种CAR-T细胞疗法的人体临床试验。相关研究结果发表在Science Translational Medicine期刊上。
CAR通常会将单抗序列整合到它的靶向结构域中,从而使得CAR-T细胞能够识别抗原并杀死肿瘤细胞。相比之下,CLTX-CAR使用的是一种长36个氨基酸的肽序列,该序列首先从致命毒蝎的毒液中分离出来,如今经改造后作为CAR识别结构域起作用。据美国癌症学会的统计,胶质母细胞瘤(glioblastoma, GBM)是最常见的脑瘤类型,也是最致命的人类癌症之一。当肿瘤扩散到整个大脑中时,它是特别难以治疗的。为GBM开发包括CAR-T细胞在内的免疫疗法的努力还必须克服这些肿瘤内的高度异质性。
图片来源:University of California, San Francisco
【6】Cell Stem Cell:新研究揭示人胶质母细胞瘤的起源
doi:10.1016/j.stem.2019.11.015
胶质母细胞瘤是脑癌中最具侵袭性的形式,它在大脑中迅速生长和扩散,几乎不可能根除,通常会在诊断后一两年内导致死亡。科学家们一直在寻求更有效的靶向疗法,但到目前为止还没有取得成功,这部分上是原因是这类肿瘤在实验室环境中难以研究。美国加州大学旧金山分校博士后研究员Aparna Bhaduri博士说,“胶质母细胞瘤在患者中具有侵袭性和顽强性,但在实验室中一直很难存活。在以前针对小鼠的胶质母细胞瘤研究中,在移植到它们的体内后,只有5%到10%的人类肿瘤能够存活下来,这使得我们猜测这类肿瘤可能在许多重要的方面不同于那些不能存活的肿瘤。”
如今,在一项新的研究中,来自加州大学旧金山分校等机构的研究人员首次在实验室中使用人大脑类器官---由人干细胞培育出的脑组织球状体---成功地让多种胶质母细胞瘤存活,相关研究结果发表在Cell Stem Cell期刊上。这些研究人员首次创建出从人类患者进行手术治疗时获取的胶质母细胞瘤的图谱,对数十种不同的细胞类型以及它们的独特基因表达模式进行分类。他们随后利用人干细胞培育出的大脑类器官来模拟这些通过遗传手段鉴定出的癌细胞类型在人大脑组织中的行为。
【7】Cell:人胶质母细胞瘤类器官可重现肿瘤特征,并可用于评价药物和CAR-T细胞的疗效
doi:10.1016/j.cell.2019.11.036
胶质母细胞瘤是最为侵袭性的最为常见的脑癌形式。由患者自身的胶质母细胞瘤培育而成的实验室大脑类器官可能为如何最好地治疗它提供了答案。在一项新的研究中,来自美国宾夕法尼亚大学的研究人员发现胶质母细胞瘤类器官可能可以作为有效的模型来快速地测试个性化治疗策略。相关研究结果发表在Cell期刊上。
多形性胶质母细胞瘤(GBM)仍然是所有脑癌中最难研究和治疗的,这主要是由于这种肿瘤的异质性。事实证明,外科手术、放疗和化疗等治疗方法以及更新的个性化细胞疗法可减缓肿瘤生长并使得患者在一段时间内保持无病状态,但是,治愈仍然是很难的。研究者Hongjun Song博士说,“尽管我们在胶质母细胞瘤研究方面取得了长足进步,但是临床前和临床挑战仍然存在着,这使得我们无法接近更有效的治疗方法。其中的一种障碍是重现这种肿瘤的能力,这样不仅可以更好地理解它的复杂特征,而且还可以确定术后哪些疗法可以更及时地对抗它。”
【8】Nat Biotechnol:基因编辑免疫细胞攻击胶质母细胞瘤
doi:10.1038/s41587-019-0246-4
来自耶鲁大学系统生物学研究所和耶鲁癌症中心的遗传学助理教授Sidi Chen实验室开发了一种先进的基因编辑和筛选技术,可以为癌症免疫治疗寻找新的靶点。近日发表在Nature Biotechnology杂志上的一项新研究中,研究人员表示,在小鼠胶质母细胞瘤模型中,使用含有这些基因靶点修饰的T细胞可以让肿瘤生长变慢。而胶质母细胞瘤是一种特别难以治疗的脑癌。
研究人员指出,大脑的免疫系统活动非常有限,因此不是一个特别有希望的免疫治疗器官。陈的实验室开发了一种复杂的病毒载体,内含转座子或跳跃基因,有助于T细胞的基因筛选能力。T细胞的基因组筛选揭示了一个目标--PDIA3,当在T细胞中的PDIA3受到抑制时,可以抑制小鼠胶质母细胞瘤的生长。研究人员还表明,在特定类型的T细胞中敲除PDIA3可以增强它们在人类胶质母细胞瘤细胞中的抗癌特性。
【9】Science子刊:药物局部诱导的IL-12基因疗法有望治疗复发性胶质母细胞瘤患者
doi:10.1126/scitranslmed.aaw5680
在一项新的临床研究中,一种可诱导的肿瘤定位基因疗法首次在胶质母细胞瘤患者中进行了测试。这种由两部分组成的方法涉及将一个编码免疫激活物的基因注射到脑瘤部位中并服用一种激活这个基因的药物,从而导致免疫激活物---白细胞介素12(IL-12)---的产生和免疫细胞渗入到肿瘤组织中。这些结果还提示着这种治疗可能延长患者的生存期。相关研究结果发表在Science Translational Medicine期刊上。研究者表示,所有近期的证据都提示着如果你能真正让免疫系统攻击肿瘤,那么你就有增加治愈肿瘤的潜力,而且这项[研究]正朝着这个方向发展。
胶质母细胞瘤是一种侵袭性和致命性的脑癌形式,在确诊后仅有6至9个月的平均生存期。领导这项研究的哈佛医学院神经外科医生Antonio Chiocca说,即使采用标准治疗(手术切除全部或部分肿瘤,然后进行6周化放疗),“平均7个月内. . .肿瘤复发了”。许多因素使得胶质母细胞瘤成为一种令人生畏的疾病。首先,血脑屏障阻止许多化疗药物到达肿瘤。这种癌症本身是高度异质的,因此即使药物对某些细胞有效,其他细胞可能生长并取代它们。此外,Chiocca说,众所周知,胶质母细胞瘤是“免疫学冷性的”,这意味着它们会产生免疫抑制环境来限制抗肿瘤免疫细胞的浸润。Lang说,“将这种冷肿瘤变成热肿瘤是新型治疗方法的策略之一”。
【10】EMBO Mol Med:鉴别出胶质母细胞瘤的致命“弱点” 有望开发出新型靶向性疗法
doi:10.15252/emmm.201809034
胶质母细胞瘤是成年人群中最流行且最具致死性的一种脑瘤,目前尚无有效的治疗手段,通过外科手术通常无法完全切除患者病灶,而且肿瘤细胞还会入侵组织并且在大脑中扩散,此外,胶质母细胞瘤细胞还对当前药物疗法会产生耐药性。长期以来科学家们一直在寻找胶质母细胞瘤细胞的弱点,以利用其开发有效的靶向性疗法,近日,一项刊登在国际杂志EMBO Molecular Medicine上的研究报告中,来自芬兰赫尔辛基大学的科学家们通过研究发现,胶质母细胞瘤细胞中小型脂肪酸结合蛋白(MDGI或FABP3)的表达会增加癌细胞侵袭到其它组织中的能力,同时还与患者较差的预后直接相关。
研究者Pirjo Laakkonen教授说道,胶质母细胞瘤细胞依赖于产生MDGI蛋白的基因的表达,抑制该基因的功能则会诱发癌细胞死亡,MDGI的缺失会引发溶酶体膜变得不稳定(溶酶体是肿瘤细胞中的清理工具),从而就会引发溶酶体中的酸性和蛋白水解酶渗透到细胞质中,进而开启癌细胞死亡的过程。研究者指出,沉默MDGI的表达会引发胶质母细胞瘤细胞中溶酶体磷脂组成的改变,从而干扰亚油酸从细胞外到细胞内的运输过程,并导致溶酶体膜中脂肪酸组成的明显改变,这种改变就会增加溶酶体膜的通透性。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


