FEBS Lett:蛋白ABCB1扭曲和挤压使癌症产生耐药性
来源:本站原创 2020-12-31 13:15
2020年12月31日讯/生物谷BIOON/---1986年,日本细胞生物化学者Kazumitsu Ueda发现,一种名为ABCB1的蛋白可以将多种化疗药物从一些癌细胞中转运出来,使得它们对治疗产生抵抗性。在过去的35年里,它是如何做到这一点的一直是个谜。如今,Ueda及其团队在FEBS Letters期刊上发表了一篇标题为“ABCB1/MDR1/P‐gp
2020年12月31日讯/生物谷BIOON/---1986年,日本细胞生物化学者Kazumitsu Ueda发现,一种名为ABCB1的蛋白可以将多种化疗药物从一些癌细胞中转运出去,使得它们对治疗产生抵抗性。在过去的35年里,它是如何做到这一点的一直是个谜。如今,Ueda及其团队在FEBS Letters期刊上发表了一篇标题为“ABCB1/MDR1/P‐gp employs an ATP‐dependent twist‐and‐squeeze mechanism to export hydrophobic drugs”的综述文章,总结了他们多年来对这种和其他ATP结合盒(ABC)转运蛋白的研究后的心得。Ueda如今在日本京都大学综合细胞材料科学研究所从事研究工作。
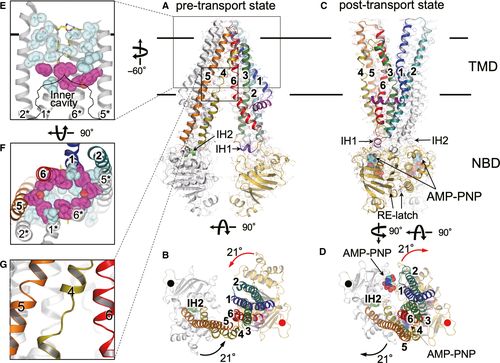
图片来自FEBS Letters, 2020, doi:10.1002/1873-3468.14018。
ABC转运蛋白在不同物种间非常相似,具有各种运输作用:将营养物输入细胞,将有毒化合物输出细胞外,以及调节细胞膜内的脂质浓度。
ABCB1就是这些蛋白中的一种,在大脑、睾丸和胎盘等重要器官中,它负责将有毒化合物转运到细胞外。但有时,它也能从癌细胞中转运出化疗药物,使它们对治疗产生抵抗力。这种蛋白横跨在细胞膜上,一端伸入细胞内,另一端伸向周围空间。尽管科学家们多年来已经知道它的作用和结构,但它究竟是如何发挥作用的一直不清楚。
Ueda和他的团队在ABCB1蛋白转运出一种化合物之前和之后让它形成晶体。他们随后进行了X射线测试,以确定这两种结构之间的差异。他们还利用与荧光蛋白融合在一起的ABCB1进行分析,以监测转运过程中的构象变化。
他们发现,注定要输出到细胞外的化合物通过位于细胞膜内的ABCB1那一部分的一个门进入这种蛋白的空腔。这种化合物停留在空腔的顶部,在那里它附着在上去,触发这种蛋白发生结构变化。这种变化需要能量,而能量来源于三磷酸腺苷(ATP)分子。当镁离子与ATP结合时,ABCB1位于细胞内的部分会紧紧地自我包装,并发生倾斜,使它的空腔收缩,然后关闭。这就打开了这种蛋白的输出口。ATP还参与让ABCB1从底部到顶部逐渐变硬,导致扭曲和挤压运动,将这种化合物排出到细胞外空间。
Ueda说,“这种机制与其他转运蛋白的机制不同。我们期待我们的研究工作能够促进对其他ABC蛋白的研究,例如那些参与胆固醇稳态的ABC蛋白。”(生物谷 Bioon.com)
参考资料:
1.Atsushi Kodan et al. ABCB1/MDR1/P‐gp employs an ATP‐dependent twist‐and‐squeeze mechanism to export hydrophobic drugs. FEBS Letters, 2020, doi:10.1002/1873-3468.14018.
2.Protein twist and squeeze confers cancer drug resistance
https://medicalxpress.com/news/2020-12-protein-confers-cancer-drug-resistance.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


