线粒体蛋白跨膜转运研究获进展
来源:合肥研究院 2020-12-24 12:10
近期,中国科学院合肥物质科学研究院强磁场中心王俊峰、周数研究团队在线粒体蛋白跨膜转运研究中取得进展,利用液体核磁共振技术,在国际上首次解析出酵母线粒体内膜Tim23通道蛋白与其底物肽段的复合物三维空间结构。相关研究成果以Solution structure of the voltage-gated Tim23 channel in c
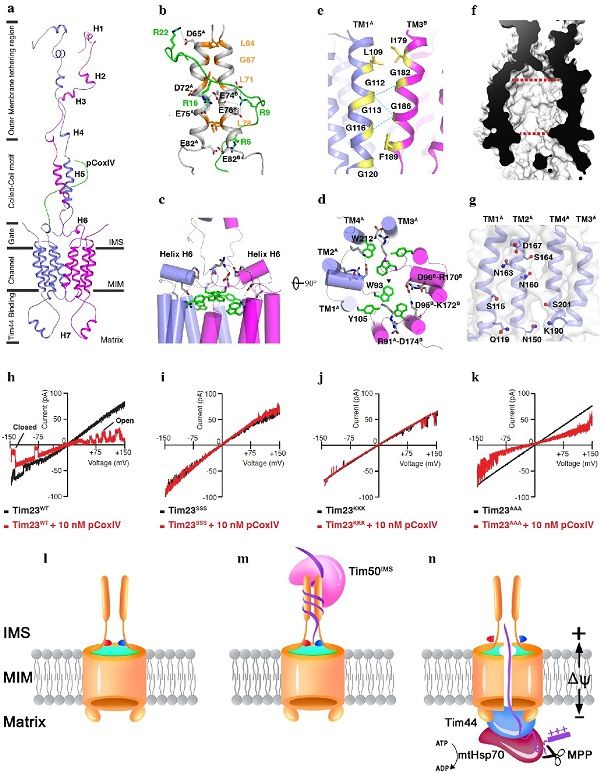
近期,中国科学院合肥物质科学研究院强磁场中心王俊峰、周数研究团队在线粒体蛋白跨膜转运研究中取得进展,利用液体核磁共振技术,在国际上首次解析出酵母线粒体内膜Tim23通道蛋白与其底物肽段的复合物三维空间结构。相关研究成果以Solution structure of the voltage-gated Tim23 channel in complex with a mitochondrial presequence peptide为题,发表在Cell Research上。
线粒体拥有复杂且精细的蛋白质转运系统以介导不同的细胞质前体蛋白转运至线粒体各区域。Tim23通道蛋白自身或在其他相关亚基帮助下,可特异性识别细胞质前体蛋白,并且转运至线粒体基质内或插入线粒体内膜中。近年来,学界在该通道蛋白的功能研究中取得较大进展,但尚不知Tim23通道蛋白的三维空间结构。
该研究解析了Tim23-pCoxIV复合物结构,其是目前利用液体核磁共振技术解析的分子量最大的膜蛋白复合物之一,并且发现了一系列独特的空间结构特点。研究发现,Tim23蛋白N端膜外区域包含了一个特异性识别、结合前体蛋白的结构域。Tim23通道蛋白的控制开关采用了双开关控制机制,其中,第一重开关是由六个带电荷氨基酸残基构成的三对离子键,存在内膜表面之上,起到电压感受器的作用;第二重开关是存在于通道顶端开口内的芳香族氨基酸侧链,起到空间位阻的作用;最后是通道的结合界面,其依靠弱氢键维系,在前体蛋白进入通道后,同时能够打破氢键,从而使通道解离为单体。基于体外电生理实验结果及上述蛋白结构特点,研究人员提出了Tim23通道蛋白跨膜转运细胞质前体蛋白的分子机制模型。
研究工作得到国家自然科学基金、中科院、欧盟Horizon 2020项目基金的资助,核磁共振实验获得稳态强磁场实验装置和德国法兰克福大学核磁中心的支持。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


