Neuron解析!自噬作用如何保护大脑神经元细胞免受损伤?
来源:本站原创 2020-11-13 22:41
2020年11月13日 讯 /生物谷BIOON/ --近日,一篇发表在国际杂志Neuron上题为“Neuronal autophagy regulates presynaptic neurotransmission by controlling the axonal endoplasmic reticulum”的研究报告中,来自莱布尼茨分子药理学研究所等机构
2020年11月13日 讯 /生物谷BIOON/ --近日,一篇发表在国际杂志Neuron上题为“Neuronal autophagy regulates presynaptic neurotransmission by controlling the axonal endoplasmic reticulum”的研究报告中,来自莱布尼茨分子药理学研究所等机构的科学家们通过研究揭示了自噬在神经元功能发挥中所扮演的关键角色。研究者指出,自噬似乎保护了大脑中的神经元细胞,而其背后的原因或许与此前假设的并不相同,当研究人员利用遗传技巧关闭自噬介导的细胞废物处理系统时(并没有像预期那样检测到蛋白质沉积物),他们发现,细胞中内质网的水平升高了,而内质网是一种由膜囊组成的系统,除了其他功能外,其还充当了钙质的储存器,这就会导致神经递质释放的升高,最终引发致命性的神经元过度兴奋。
自噬在健康细胞的功能维持过程中扮演着关键角色,其中一个典型例子就是通过所谓的自噬体来降解并回收损伤的蛋白质分子或整个细胞器,比如缺陷的线粒体等;这种清理机制对于大脑中的神经元尤其重要,自噬能够帮助清理蛋白质沉积物,比如在神经变性疾病发生过程中出现的蛋白质等,自噬的神经保护效应如今也已经被科学家们利用模式生物进行研究证实了。然而,这种保护性效应的原因或许与研究人员此前假设的并不相同,通过调查自噬在年轻健康小鼠中枢神经系统中所扮演的关键角色,研究人员如今取得了新的研究发现。
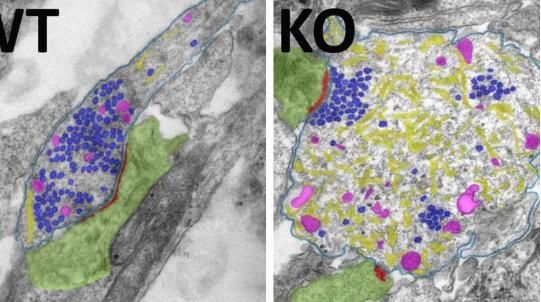
图片来源:Dmytro Puchkov, Marijn Kuijpers
文章中,他们利用遗传技巧首先关闭了必要的自噬基因,随后利用蛋白质组学技术分析了神经元中蛋白质的水平,而此前假设主要由自噬过程降解的蛋白质或许根本就没有在神经元中富集,如果其降解是通过自噬过程发生的,这或许就是可以预料的。文章中,研究人员并未发现预期的自噬底物,而是在神经元轴突中发现了异常高水平的内质网,这些膜囊和小管的功能之一就是为钙质提供大量的细胞内储存,细胞中钙质的调节对中枢神经系统的兴奋性传输至关重要,当神经元彼此间相互交流时,钙离子通道就会在突触处打开,从而导致钙质从外涌入突触,同时还会导致突触小泡释放神经递质,这样钙质就会被泵出神经元或者进入到内质网内,当然也可以根据需要进行释放。
当自噬功能被关闭时,内质网中钙质的储存就会被破坏,研究者发现,内质网的钙质缓冲功能或许不会再正常发挥作用,从而就会导致轴突和突触中的钙质水平升高,反过来又会增强兴奋性地址谷氨酸的释放,并导致永久性的神经元兴奋过度。研究者Marijn Kuijpers说道,直到现在研究人员都认为,自噬水平的减少意味着会释放更少的神经递质分子,而如今我们已经证明了完全相反的情况,这或许是神经递质释放过多(而不是过少)导致的,因此神经元的可塑性会变差,研究人员推测其最终会因兴奋过度而发生死亡。
由于本文研究是利用年轻动物的健康神经元进行的,所以不排除在病理学条件下自噬会产生其它额外的功能,比如阿尔兹海默病等,也就是说,本文研究对于科学家们从根本上理解自噬的生理学意义具有非常重要的作用。综合来讲,本文研究发现有望帮助科学家们理解自噬作用在中枢神经系统中或许扮演着关键角色,相关研究结果也能帮助解释为何随着自噬功能在衰老过程中不断下降,机体的学习会变得更加困难。
如今研究人员尚未解决到底是哪些调节性机制诱发了神经元细胞中的自噬过程,尽管营养物质的可用性对机体的其它细胞有着调节性的效应,比如禁食被证明能刺激细胞的废物处理过程,但迄今为止研究人员尚未阐明中枢神经系统中自噬的触发机制;最后研究者Haucke说道,如果我们知道是什么能在神经元细胞中产生过多或过少的自噬作用,未来我们或许会在患者疾病进展的某个阶段进行主动干预,后期我们还会继续通过更为深入的研究来理解相关的问题,而本文研究或许为后期科学家们进一步研究提供了一个很好的起点。(生物谷Bioon.com)
参考资料:
【1】Marijn Kuijpers,Gaga Kochlamazashvili,Alexander Stumpf, et al. Neuronal Autophagy Regulates Presynaptic Neurotransmission by Controlling the Axonal Endoplasmic Reticulum, Neuron (2020) doi:10.1016/j.neuron.2020.10.005
【2】Surprising insights into the role of autophagy in neuron
by Forschungsverbund Berlin e.V. (FVB)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


