唐本忠院士团队成功构建了具有可逆融合-分裂行为的人工外泌体
来源:高分子科学前沿 2020-09-02 12:41
外泌体(exosome),是细胞外囊泡(EV)的一种主要类型,是直径为30至150 nm的纳米大小的膜结构,大多数细胞都会分泌外泌体。许多研究表明,外泌体通过转移不同的货物(包括蛋白质、DNA、miRNA、lncRNA、circRNA,以及mRNA)参与生理活动和病理变化中的细胞间通讯。细胞间通讯过程中通常涉及一个细胞释放新囊泡的分裂过程和另一个
外泌体(exosome),是细胞外囊泡(EV)的一种主要类型,是直径为30至150 nm的纳米大小的膜结构,大多数细胞都会分泌外泌体。许多研究表明,外泌体通过转移不同的货物(包括蛋白质、DNA、miRNA、lncRNA、circRNA,以及mRNA)参与生理活动和病理变化中的细胞间通讯。细胞间通讯过程中通常涉及一个细胞释放新囊泡的分裂过程和另一个细胞吞噬的融合过程,而这两个过程在活细胞器中通常是可逆和可控的。
然而,由于外泌体的复杂组成和细胞环境,关于融合和分裂过程的膜行为的知识及其调控因素仍然很少。这一障碍激发了具有与外泌体相似结构和分裂融合行为的人工囊泡的发展。
近日,唐本忠院士和深圳大学王东副教授、北京大学阎云研究员合作,在Angewandte Chemie International Edition杂志上发表了题为:Exosome-Mimetic Supramolecular Vesicles with Reversible and Controllable Fusion and Fission的文章。
该论文提出了具有氧化还原调节的可逆融合-分裂功能的人工超分子囊泡。这些囊泡在氧化时趋向于融合在一起形成大尺寸的囊泡,通过还原大囊泡分裂回到小尺寸的囊泡。超分子构建块的聚集诱导发射(AIE)特性使荧光技术能够监测囊泡转化过程中的分子构型。此外,这种囊泡是将siRNA递送到癌细胞的极好的纳米载体。
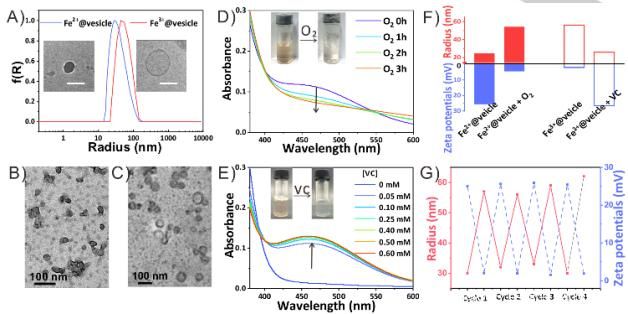
通过AIE活性分子TPE-BPA、十六烷基三甲基溴化铵(CTAB)和Fe2+离子的自组装构建了Fe2+配位囊泡。TPE-BPA是一种带负电荷的四臂分子,在聚集态表现出强烈的荧光发射。它能够通过离子相互作用与八个带正电荷的CTAB分子结合,自发地自组装成中性荧光囊泡。TPE-BPA还带有配位头,使TPE-BPA@CTAB超分子囊泡能够与许多金属离子配位,如Fe2+和Fe3+。囊泡状结构可能具有多层结构,其中TPE-BPA作为膜的骨架。Fe2+@囊泡的平均半径为25nm,而Fe3+@囊泡为54nm。
氧化还原处理实现囊泡可逆转化。向Fe2+@囊泡中通入氧气,462nm处的紫外吸收(这是Fe2+与TPE-BPA配位基团之间的特定配位特征)逐渐降低,Zeta电位从25mv下降到5mv,同时囊泡半径从25nm增加到54nm。证明了Fe2+@囊泡转化为Fe3+@囊泡。另一方面,加入还原性维生素C,Fe3+@囊泡在462nm处紫外吸收逐渐增加,表明Fe2+和TPE-BPA之间出现配位现象。同时,所生成囊泡的Zeta电位、囊泡的大小和形态都与Fe2+@囊泡相同。
可逆和可控的融合和分裂行为的可能机制:在Fe2+@囊泡中,由于Fe2+离子配位产生的正电荷的强静电排斥作用,TPE-BPA分子趋向于相互排斥并堆积成松散状态。因此囊泡的膜曲率较大,半径较小。当Fe2+被O2氧化成Fe3+时,由于Fe3+离子大部分被水解,生成的水合物的配位能力可忽略,正电荷和静电斥力急剧减弱,形成囊泡膜的致密堆积。因此,囊泡融合在一起,降低了它们的相互作用自由能,形成了曲率较小的大尺寸囊泡。相反,加入VC后,Fe3+及其水合物转化为Fe2+离子,对囊泡具有良好的配位能力。静电斥力的增加会引起囊泡的分裂,进而产生具有大曲率的小尺寸囊泡。
利用AIE分子的荧光发射,实现囊泡转化过程中分子堆积结构的实时监测。由于Fe2+和Fe3+离子都会使荧光猝灭,因此采用Co2+离子进行评价。Co2+离子的逐步添加导致囊泡尺寸减小和Zeta电位增加,对应于电荷引起的分裂过程。同时,荧光发射逐渐减少和蓝移。表明了AIE分子在分裂过程中呈现出越来越扭曲的形态,并松散地堆积在一起。相反,当EDTA被添加到Co2+@囊泡中去除膜中的电荷,囊泡的增大和Zeta电位的减小,意味着囊泡融合。此外,荧光发射逐渐增强和红移,表明AIE分子在融合过程中变得更加密集。
利用仿外泌体囊泡进行药物输送。siRNA是最有前途的肿瘤治疗药物之一。当siRNA加入到Fe2+@囊泡溶液中,Zeta电位降低,这表明siRNA与囊泡结合。siRNA通过siRNA@囊泡的细胞内吞作用被HeLa细胞有效地摄取,然后释放到细胞质中。这可能是由于癌细胞的细胞内氧化环境所致,细胞吞噬的Fe2+@囊泡被癌细胞内丰富的H2O2氧化为Fe3+@囊泡,从而导致正电荷的减少,削弱了与siRNA的相互作用。
亮点小结
作者成功地制备了一个具有可逆的融合和分裂行为的仿外泌体囊泡。当Fe3+的被氧化成Fe3+,由于Fe3+离子的水解降低了它们的配位能力,使囊泡的正电荷被去除。因此,囊泡趋向于融合在一起,形成大尺寸的囊泡以降低自由能。相反,当Fe3+还原为Fe2+时,电荷恢复,静电斥力增强,通过分裂过程形成小尺寸的囊泡。此外,利用囊泡构建块的AIE特性,可以监测囊泡转化过程中的分子堆积状态。这项研究将为外泌体的融合和分裂行为提供创新性的理解。另外,与传统的“分解”释药方式不同,仿外泌体囊泡通过融合过程释放载药siRNA,为药物释放系统提供了新的候选方案。(生物谷Bioon.com)
小编推荐会议 2020(第五届)外泌体与疾病研讨会
http://meeting.bioon.com/2020Exosomes?__token=liaodefeng
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


